题目内容
1. 某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.
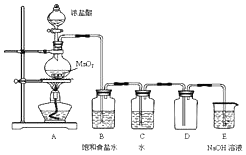
某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.【实验一】制备饱和氯水,使用以下装置并在装置中加入相应试剂,按要求进行操作.请回答:
(1)A装置中发生反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
往100mL 12mol•L-1的浓盐酸中加入足量二氧化锰并加热,充分反应后,被氧化HCl的物质的量为A
A.小于0.6mol B.等于0.6mol C.大于0.6mol D.等于1.2mol
(2)E装置的作用是尾气处理,吸收过量的氯气.
【实验二】探究饱和氯水与CaCO3的反应.步骤如下:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应.有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
第三份进行加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2,请回答:
(4)反应后所得的溶液漂白性增强的原因是碳酸钙消耗了氯水中的H+,使Cl2+H2O?H++Cl-+HClO平衡正向移动,HClO浓度大,漂白效果增强;
(5)依据上述实验可推知,②的滤液中的溶质除CaCl2、HClO外,还含有Ca(HCO3)2..
分析 (1)A装置中二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,据此书写方程式;依据浓盐酸与二氧化锰反应,稀盐酸与二氧化锰不反应解答;
(2)氯气有毒,直接排放能引起空气污染,应进行尾气处理;
(4)氯水中存在平衡移动,依据化学平衡移动原理,可知盐酸能够与碳酸钙反应,消耗氢离子,使平衡正向移动,HClO浓度大,漂白效果好;
(5)氯水中含盐酸、次氯酸,由③可知滤液中溶质加热,看到溶液变浑浊且有大量无色气体产生为CO2,以此解答.
解答 解:(1)A装置中二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,反应的方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
往100mL 12mol•L-1的浓盐酸中含有氯化氢物质的量为:1.2mol,加入足量二氧化锰并加热,充分反应后,依据MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,如果氯化氢完全反应,则被氧化的氯化物质的量为0.6mol,但是随着反应进行,盐酸浓度逐渐降低变为稀盐酸,稀盐酸不与二氧化锰反应,所以实际被氧化的氯化氢物质的量小于0.6mol,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;A;
(2)氯气有毒,直接排放能引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠溶液吸收过量的氯气;
故答案为:尾气处理,吸收过量的氯气;
(4)氯水中存在平衡移动,碳酸钙消耗了氯水中的H+,使Cl2+H2O?H++Cl-+HClO平衡正向移动,HClO浓度大,漂白效果增强,
故答案为:碳酸钙消耗了氯水中的H+,使Cl2+H2O?H++Cl-+HClO平衡正向移动,HClO浓度大,漂白效果增强;
(5)氯水中含盐酸、次氯酸,由③可知滤液中溶质加热,看到溶液变浑浊且有大量无色气体产生为CO2,则②的滤液中的溶质除CaCl2、HClO外,还含有Ca(HCO3)2,
故答案为:Ca(HCO3)2.
点评 本题考查了氯气的制备、氯水的性质检验,明确氯气制备原理及氯气成分是解题关键,注意化学平衡移动原理的应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 乙炔 | B. | 1,3-丁二烯 | C. | 环己烷 | D. | 乙烯 |
 巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
巴蜀化学课外小组用海带为原料制取了少量碘水,现用CCl4 (沸点76.8℃)从碘水中萃取碘并用分液漏斗分离两种溶液.实验操作可分解为如下几步:
 、
、 、
、 ;C6H5OCH3.
;C6H5OCH3.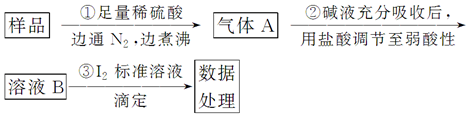
 铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.
铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.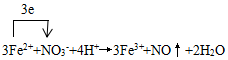 ;
;