题目内容
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分(未表示H+和OH-)及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为 (填“酸性”、“碱性”或“中性”).
(2)NOx是汽车尾气中的主要污染物之一.
汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1: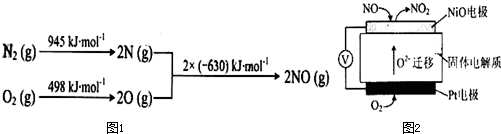
写出该反应的热化学方程式: .
(3)一定条件下,NOX在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式并用单线桥表示出电子转移的方向和数目: .
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2:
①Pt电极上发生的是 反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式 .
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分(未表示H+和OH-)及其平均浓度如下表:
| 离子 | K+ | Na+ | SO42- | NO3- |
| 浓度/mol?L-1 | 2×10-6 | 3×10-6 | 2×10-5 | 1.5×10-5 |
(2)NOx是汽车尾气中的主要污染物之一.
汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1:

写出该反应的热化学方程式:
(3)一定条件下,NOX在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式并用单线桥表示出电子转移的方向和数目:
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2:
①Pt电极上发生的是
②写出NiO电极的电极反应式
考点:常见的生活环境的污染及治理,原电池和电解池的工作原理,氮的氧化物的性质及其对环境的影响
专题:电化学专题,元素及其化合物
分析:(1)依据电荷守恒,求出氢离子、氢氧根离子的浓度相对大小,由此判断出PM2.5的酸碱性为酸性;
(2)根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,据此书写热化学方程式;
(3)NO被CO还原,则CO被NO氧化生成二氧化碳,用单线桥标注氧化还原反应电子转移总数为4,据此写出反应方程式;
(4)①原电池中正极得电子的物质发生还原反应;
②NiO电极上NO失电子和氧离子反应生成二氧化氮;
(2)根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,据此书写热化学方程式;
(3)NO被CO还原,则CO被NO氧化生成二氧化碳,用单线桥标注氧化还原反应电子转移总数为4,据此写出反应方程式;
(4)①原电池中正极得电子的物质发生还原反应;
②NiO电极上NO失电子和氧离子反应生成二氧化氮;
解答:
解:(1)根据电荷守恒得:[H+]+[K+]+[Na+]+=2[SO42-]+[NO3-]+[OH-],将表中数据带入得:[H+]-[OH-]=5×10-5>1×10-7,PM2.5显酸性,
故答案为:酸性;
(2)该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以其热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+183kJ/mol,
故答案为:N2(g)+O2(g)=2NO(g)△H=+183kJ/mol;
(3)在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:2CO+2NO
N2+2CO2,氮元素从一氧化氮中+2价变为氮气中0价,电子从碳转移给氮元素,电子转移总数为4,
用单线桥标注化学方程式为: ,
,
故答案为: ;
;
(4)①装置无外接电源,故为原电池,铂电极上氧气得电子生成氧离子而被还原,
故答案为:还原;
②NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为:NO+O2--2e-=NO2,
故答案为:NO+O2--2e-=NO2;
故答案为:酸性;
(2)该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以其热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+183kJ/mol,
故答案为:N2(g)+O2(g)=2NO(g)△H=+183kJ/mol;
(3)在催化剂条件下,一氧化碳被氧化生成二氧化碳,一氧化氮被还原生成氮气,所以其反应方程式为:2CO+2NO
| ||
用单线桥标注化学方程式为:
 ,
,故答案为:
 ;
;(4)①装置无外接电源,故为原电池,铂电极上氧气得电子生成氧离子而被还原,
故答案为:还原;
②NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为:NO+O2--2e-=NO2,
故答案为:NO+O2--2e-=NO2;
点评:本题考查的知识点较多,既考查了电化学、电子转移又考查了反应热的问题,对学生综合运用知识能力有一定的要求,特别是根据图中信息写电极反应,要求学生有较好从图中获取信息的能力,题目难度中等.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
下列现象或应用不能用胶体知识解释的是( )
| A、在河流入海口处易形成三角沙洲 |
| B、用明矾净化饮用水 |
| C、在氯化铁溶液中滴加氢氧化钠溶液出现红褐色沉淀 |
| D、用石膏或卤水点制豆腐 |
下列离子方程式书写正确的是( )
| A、Cu与AgNO3溶液反应:Cu+2Ag+=Cu2++2Ag |
| B、CaCO3和盐酸反应:CO32-+2H+=H2O+CO2↑ |
| C、Fe和稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑ |
| D、Ba(OH)2与稀H2SO4反应:OH-+H++Ba2++SO42-=BaSO4↓+H2O |
 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.如图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )| A、催化剂b表面的反应是CO2+2H++2e-═HCOOH |
| B、催化剂a表面发生氧化反应,有O2产生 |
| C、催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| D、该过程是将太阳能转化为化学能的过程 |
下列说法正确的是( )
| A、同周期元素的第一电离能从左往右越来越大 |
| B、同主族元素从上到下第一电离能越来越大 |
| C、同周期元素的电负性从左往右越来越大 |
| D、同主族元素从上到下电负性越来越大 |


 保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品.
保险粉(Na2S2O4)有极强的还原性,遇水或在潮湿空气中会分解发热,甚至引起燃烧,但在碱性环境下较稳定.某实验小组利用如图装置制取保险粉,并验证其还原性.在35~45℃下,将SO2气体通入锌粉-水悬浮液中,生成ZnS2O4;待反应完全后,冷却至室温,向三颈烧瓶中加入18%的NaOH溶液,生成Na2S2O4和Zn(OH)2;经一系列操作获得无水Na2S2O4样品. 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.