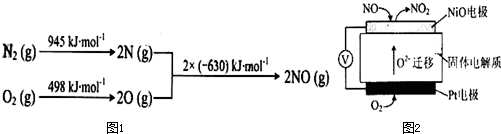
题目内容
向含0.2molNaOH和0.1mol Ba(OH)2的溶液中持续稳定地通入6.72L(标准状况)CO2气体.下列表示溶液中离子的物质的量与通入CO2的体积关系的图象中,符合题意的是(气体的溶解和离子的水解都忽略不计)( )
A、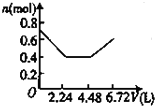 |
B、 |
C、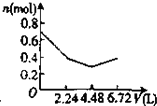 |
D、 |
考点:离子方程式的有关计算
专题:图示题
分析:n(CO2)=
=0.3mol,通入含有0.2mol氢氧化钠和0.1mol氢氧化钡的溶液中,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ba2++CO32-=BaCO3↓,以此解答该题.
| 6.72L |
| 22.4L/mol |
解答:
解:n(CO2)=
=0.3mol,含有0.2mol氢氧化钠和0.1mol氢氧化钡的溶液中:n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,
n(Ba2+)=0.1mol,
通入CO2,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ba2++CO32-=BaCO3↓,
设生成xmolCO32-,ymolHCO3-,
则:
解得x=0.1,y=0.2,
所以反应后溶液中含有:n(Na+)=0.2mol,n(HCO3-)=0.2mol,
可依次发生:①2OH-+CO2=CO32-+H2O,
②Ba2++CO32-=CaCO3↓,离子浓度迅速减小,
③OH-+CO2=HCO3-,
所以图象C符合,
故选:C.
| 6.72L |
| 22.4L/mol |
n(Ba2+)=0.1mol,
通入CO2,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ba2++CO32-=BaCO3↓,
设生成xmolCO32-,ymolHCO3-,
则:
|
解得x=0.1,y=0.2,
所以反应后溶液中含有:n(Na+)=0.2mol,n(HCO3-)=0.2mol,
可依次发生:①2OH-+CO2=CO32-+H2O,
②Ba2++CO32-=CaCO3↓,离子浓度迅速减小,
③OH-+CO2=HCO3-,
所以图象C符合,
故选:C.
点评:本题考查离子方程式的计算,题目难度较大,解答本题时注意B和C的区别,为易错点.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
铝硅合金在凝固时收缩率很小,因此这种合金适合铸造,现有下列三种晶体①铝 ②硅③铝硅合金,它们的熔点从低到高的顺序为( )
| A、①<②<③ |
| B、②<①<③ |
| C、①<③<② |
| D、③<①<② |
下列对溶液、胶体和浊液的认识正确的是( )
| A、三种分散系的分散质均能通过滤纸 |
| B、胶体在一定的条件下也能稳定存在 |
| C、溶液和胶体通常都是无色透明的液体,而浊液不透明 |
| D、胶体区别于其他分散系的本质特征是产生丁达尔现象 |
下列说法中正确的是(NA表示阿伏加德罗常数)( )
| A、4℃时,5.4mL水中所含的水分子数是0.3NA(4℃时,水的密度为1.0g/ml) |
| B、在常温常压下,11.2L氯气所含的原子数为NA |
| C、标准状况下,22.4L氢气所含的质子数为2 NA |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3 NA |
最近医学界通过用放射性14C标记C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),下列有关14C的叙述正确的是( )
| A、与普通碳原子的化学性质不同 |
| B、与14N含的中子数相同 |
| C、是金刚石的同素异形体 |
| D、与12C互为同位素 |
加热A2B5气体按下式分解:
A2B5(g)?A2B3(g)+B2(g) ①
A2B3(g)?A2B+B2(g) ②
在容积为2L的密闭容器中将4mol A2B3加热至t℃,达到平衡后,B2浓度为0.5mol?L-1,A2B5浓度为0.7mol?L-1,则t℃时A2B3的平衡浓度是( )
A2B5(g)?A2B3(g)+B2(g) ①
A2B3(g)?A2B+B2(g) ②
在容积为2L的密闭容器中将4mol A2B3加热至t℃,达到平衡后,B2浓度为0.5mol?L-1,A2B5浓度为0.7mol?L-1,则t℃时A2B3的平衡浓度是( )
| A、1.5 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.1 mol?L-1 |
| D、0.9 mol?L-1 |