题目内容
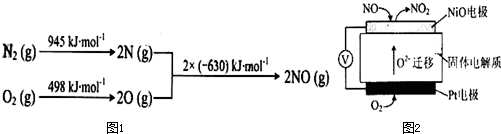
 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.
常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积),根据图中信息回答下列问题.(1)0到t2时电路中通过的电子数为多少?
(2)原混合溶液NaCl和CuSO4的物质的量浓度.
(3)t2时所得溶液中氢离子的浓度为多少.
考点:电解原理
专题:电化学专题
分析:本题的关健是对图象的解读.刚开始时阴极Cu2+得电子,Cu2+反应完溶液中的H+放电,Ⅰ是H2,阳极先是溶液中的Cl-放电,反应完后溶液中的OH-放电,电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,计算时抓住电子守恒.
解答:
解:(1)电解200mL一定浓度的NaCl与CuSO4混合溶液,阳极发生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,阴极发生Cu2++2e-=Cu、2H++2e-=H2↑,结合图可知,Ⅰ为阴极气体体积与时间的关系,Ⅱ为阳极气体体积与时间的关系,产生的是氯气,2Cl--2e-=Cl2↑,产生氯气是224mL,物质的量是0.01mol,转移电子是0.02mol,Ⅱ曲线中由t2时生成氧气为112mL,n(O2)=
=0.005mol,则共转移电子为0.02mol+0.005mol×4=0.04mol,所以0到t2时电路中通过的电子数为0.04NA,故答案为:0.04NA;
(2)由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=
×2=0.02mol,所以c(NaCl)=
=0.1mol/L根据电子守恒及Cu2++2e-=Cu可知,n(CuSO4)=
=0.02mol,所以c(CuSO4)=
=0.1mol/L,
故答案为:0.1mol/L;
(3)由t2时4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=
=0.1mol/L,
故答案为:0.1mol/L.
| 0.112L |
| 22.4L/mol |
(2)由图可知,产生氯气为224mL,则由2Cl--2e-=Cl2↑可知,n(NaCl)=
| 0.224L |
| 22.4L/mol |
| 0.02mol |
| 0.2L |
| 0.04mol |
| 2 |
| 0.02mol |
| 0.2L |
故答案为:0.1mol/L;
(3)由t2时4OH--4e-=O2↑+2H2O~4H+,n(H+)=0.005mol×4=0.02mol,则溶液的c(H+)=
| 0.02mol |
| 0.2L |
故答案为:0.1mol/L.
点评:本题考查电解原理,明确发生的电极反应及图图象的对应关系是解答本题的关键,注意把握电极反应式的书写,为解该题的关键,题目难度中等.

练习册系列答案
相关题目
一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.9kJ?mol-1,下列叙述正确的是( )
| A、4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ |
| B、平衡时v正(O2)=v逆(NO) |
| C、平衡后减小压强,混合气体平均摩尔质量增大 |
| D、平衡后升高温度,混合气体中NO含量降低 |
乙烷和丙烷的混合气体完全燃烧后,先将产物通过浓硫酸,浓硫酸增重3.06g,然后通过Na2O2固体,Na2O2固体增重3.36g,则原混合气体中乙烷和丙烷的物质的量之比为( )
| A、1:1 | B、3:5 |
| C、2:3 | D、3:2 |
加热A2B5气体按下式分解:
A2B5(g)?A2B3(g)+B2(g) ①
A2B3(g)?A2B+B2(g) ②
在容积为2L的密闭容器中将4mol A2B3加热至t℃,达到平衡后,B2浓度为0.5mol?L-1,A2B5浓度为0.7mol?L-1,则t℃时A2B3的平衡浓度是( )
A2B5(g)?A2B3(g)+B2(g) ①
A2B3(g)?A2B+B2(g) ②
在容积为2L的密闭容器中将4mol A2B3加热至t℃,达到平衡后,B2浓度为0.5mol?L-1,A2B5浓度为0.7mol?L-1,则t℃时A2B3的平衡浓度是( )
| A、1.5 mol?L-1 |
| B、0.2 mol?L-1 |
| C、0.1 mol?L-1 |
| D、0.9 mol?L-1 |
要把溶液中的Ag+、Al3+、Mg2+、Ba2+一一沉淀出来,则应依次加入( )
| A、Cl-、SO42-、OH-、H+ |
| B、SO42-、Cl-、OH-、H+ |
| C、Cl-、SO42-、OH-、CO2 |
| D、OH-、Cl-、SO42-、H+ |