题目内容
17.现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图: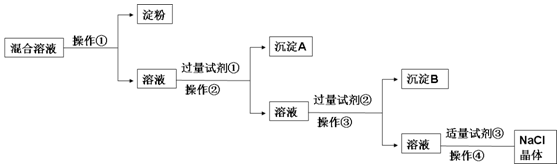
(1)操作①是利用胶体不能通过半透膜而把淀粉胶体和溶液进行分离.
(2)写出上述实验过程中所用试剂的化学式:试剂①BaCl2;试剂③HCl.
(3)判断试剂①已过量的操作是:静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量.
(4)控制试剂③适量的方法是:当溶液中不产生气泡时,就可以停止加盐酸.
(5)试剂②的作用(用化学方程式表示):Ba2++CO32-=BaCO3↓.
分析 胶体不能透过半透膜,操作①为渗析,除去Na2SO4、CaCl2,可分别加入BaCl2、Na2CO3,除去粗盐中含有的Ca2+、SO42-可溶性杂质的方法:加入过量BaCl2,去除硫酸根离子;再加入过量Na2CO3(去除钙离子),则试剂①为BaCl2,操作②为过滤,沉淀A为硫酸钡,试剂②为Na2CO3,操作③为过滤,沉淀B为碳酸钙和碳酸钡,试剂③为盐酸,加入盐酸可除去过量的Na2CO3,最后蒸发结晶可得到NaCl晶体,以此解答该题.
解答 解:(1)淀粉为胶体,粒子直径较大,不能透过半透膜,所以可以把淀粉胶体和溶液进行分离,故答案为:半透膜;
(2)由以上分析可知试剂①为BaCl2,试剂③为HCl,故答案为:BaCl2;HCl;
(3)判断试剂①已过量的方法是静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量,
故答案为:静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量;
(4)试剂③为盐酸,加入盐酸可除去过量的Na2CO3,同时产生气泡,所以控制试剂③适量的方法是观察溶液中是否有气泡出现,当溶液中不产生气泡时,就可以停止加盐酸,故答案为:当溶液中不产生气泡时,就可以停止加盐酸;
(5)试剂②为Na2CO3,是用来除去溶液中的钡离子的,反应的离子方程式为Ba2++CO32-=BaCO3↓,
故答案为:Ba2++CO32-=BaCO3↓.
点评 本题考查物质的分离提纯操作以及溶液的配制,为高频考点,题目难度中等,本题注意Ca2+、SO42-的性质,把握除杂原则,提纯时不能引入新的杂质,注意把握实验的先后顺序.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.在两个恒温、恒容的密闭容器中进行下列两个可逆反应:(甲)2X(g)?Y(g);(乙)A(s)+2B(g)?C(g)+D(g),当下列物理量不再发生变化时( )
①混合气体的密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于系数之比 ④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量.其中能表明(甲) (乙)达到化学平衡状态有.
①混合气体的密度 ②反应容器中生成物的百分含量 ③反应物的消耗速率与生成物的消耗速率之比等于系数之比 ④混合气体的压强 ⑤混合气体的平均相对分子质量 ⑥混合气体的总物质的量.其中能表明(甲) (乙)达到化学平衡状态有.
| A. | ①②③⑤ | B. | ①③⑤⑥ | C. | ②③⑤ | D. | ②③④ |
8. 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I
CO2(g)+H2(g)?CO(g)+H2O(g)△H2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
【备注】Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醛的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$;反应II的△H2=+41.2kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂Cat.1B.使用催化剂Cat.2C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响.
(4)在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6H++6e-=CH3OH+H2O.
 催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:
催化还原CO2是解决温室效应及能源问题的重要手段之一.研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平衡反应,分别生成CH3OH和CO.反应的热化学方程式如下:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-53.7kJ•mol-1 I
CO2(g)+H2(g)?CO(g)+H2O(g)△H2 II
某实验室控制CO2和H2初始投料比为1:2.2,经过相同反应时间测得如下实验数据:
| T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| 543 | Cat.1 | 12.3 | 42.3 |
| 543 | Cat.2 | 10.9 | 72.7 |
| 553 | Cat.1 | 15.3 | 39.1 |
| 553 | Cat.2 | 12.0 | 71.6 |
已知:①CO和H2的标准燃烧热分别为-283.0kJ•mol-1和-285.8kJ•mol-1
②H2O(l)═H2O(g)△H3=44.0kJ•mol-1
请回答(不考虑温度对△H的影响):
(1)反应I的平衡常数表达式K=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{c(C{O}_{2})•{c}^{3}({H}_{2})}$;反应II的△H2=+41.2kJ•mol-1.
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有CD.
A.使用催化剂Cat.1B.使用催化剂Cat.2C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是表中数据表明此时未达到平衡,不同的催化剂对反应Ⅰ的催化能力不同,因而在该时刻下对甲醇选择性有影响.
(4)在图中分别画出I在无催化剂、有Cat.1和由Cat.2三种情况下“反应过程-能量”示意图.
(5)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在阴极,该电极反应式是CO2+6H++6e-=CH3OH+H2O.
2.实验室用密度为1.25g/ml,质量分数为36.5%浓盐酸配制250ml0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250ml0.1mol/L的盐酸溶液
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCADFE
A.用30ml水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
E.将容量瓶盖紧,振荡,摇匀
F.改用胶头滴管加水,使溶液凹面恰好与刻度相切
(3)操作A中,将洗涤液均注入容量瓶,其目的是防止烧杯中的残留液没有移入容量瓶使溶液浓度减少.溶液注入容量瓶前需恢复到室温,这是因为盐酸溶解放热使溶液体积膨胀,不冷却会使溶液浓度增大..
(4)若实验过程中出现下列情况如何处理?
加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面重新配制.
(1)配制250ml0.1mol/L的盐酸溶液
| 应量取盐酸体积/ml | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它仪器 |
A.用30ml水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加少量水(约30ml),用玻璃棒慢慢搅动,使其混合均匀
C.将冷却的盐酸沿玻璃棒注入250ml的容量瓶中
D.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
E.将容量瓶盖紧,振荡,摇匀
F.改用胶头滴管加水,使溶液凹面恰好与刻度相切
(3)操作A中,将洗涤液均注入容量瓶,其目的是防止烧杯中的残留液没有移入容量瓶使溶液浓度减少.溶液注入容量瓶前需恢复到室温,这是因为盐酸溶解放热使溶液体积膨胀,不冷却会使溶液浓度增大..
(4)若实验过程中出现下列情况如何处理?
加蒸馏水时不慎超过了刻度重新配制;向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面重新配制.
7.常温常压下为气体的有机物是( )
①一氯甲烷 ②二氯甲烷 ③甲醇 ④甲醛 ⑤乙酸.
①一氯甲烷 ②二氯甲烷 ③甲醇 ④甲醛 ⑤乙酸.
| A. | ①② | B. | ②④⑤ | C. | ③⑤ | D. | ①④ |
 根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,
根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,