题目内容
13.试计算:(l)实验室欲配制500mL0.1mol•L-1NaOH溶液.求所需要NaOH固体的质量
(2)取(1)所配制溶液100mL与0.1mol•L-1H2SO4溶液完全反应,求所需H2SO4溶液的体积.
分析 (1)根据n=cV计算NaOH的物质的量,再根据m=nM计算NaOH的质量;
(2)根据n=cV计算NaOH的物质的量,根据方程式计算消耗H2SO4的物质的量,根据V=$\frac{n}{c}$计算需要硫酸溶液体积.
解答 解:(1)n(NaOH)=0.5L×0.1mol/L=0.05mol,则m(NaOH)=0.05mol×40g/mol=2.0g,
答:需要NaOH固体质量为2.0g;
(2)100mL溶液中NaOH物质的量为0.1L×0.1mol/L=0.01mol,
由2NaOH+H2SO4=Na2SO4+H2O,可知需要H2SO4 的物质的量为0.01mol×$\frac{1}{2}$=0.005mol,故所需H2SO4溶液的体积为$\frac{0.005mol}{0.1mol/L}$=0.05L,即所需H2SO4溶液的体积为50mL,
答:所需H2SO4溶液的体积为50mL.
点评 本题考查物质的量浓度有关计算,注意对物质的量浓度定义式的理解与灵活运用,有利于基础知识的巩固.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
3.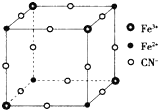 有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法错误的是( )
有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法错误的是( )
 有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法错误的是( )
有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法错误的是( )| A. | 该晶体的化学式为MFe2(CN)6 | |
| B. | 该晶体熔融可导电,且属于化学变化 | |
| C. | 该晶体属于离子晶体,M呈+2价 | |
| D. | 晶体中与每个Fe3+距离最近且等距离的CN-为6个 |
4.下列关于物质分类的说法正确的是( )
①稀豆浆、硅酸、氯化铁溶液都属于胶体
②氯水、次氯酸都属于弱电解质
③Na2O、MgO、Al2O3均属于碱性氧化物
④明矾、冰水混合物、四氧化三铁都不是混合物
⑤电解熔融的Al2O3、12C 转化为14C 都属于化学变化
⑥葡萄糖、油脂都不属于有机高分子.
①稀豆浆、硅酸、氯化铁溶液都属于胶体
②氯水、次氯酸都属于弱电解质
③Na2O、MgO、Al2O3均属于碱性氧化物
④明矾、冰水混合物、四氧化三铁都不是混合物
⑤电解熔融的Al2O3、12C 转化为14C 都属于化学变化
⑥葡萄糖、油脂都不属于有机高分子.
| A. | ①② | B. | ②④ | C. | ③⑤ | D. | ④⑥ |
1.有关下列能量转化的认识不正确的是( )
| A. | 植物的光合作用使得太阳能转化为了化学能 | |
| B. | 燃料燃烧时只是将化学能转化为了热能 | |
| C. | 生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理、有效 | |
| D. | 人类使用照明设备是将电能转化为了光能 |
8.合金具有优良的机械性能,用途广泛.下列物质属于合金的是( )
| A. | 铝 | B. | 青铜 | C. | 石英 | D. | 金刚石 |
5.13C-NMR(核磁共振)、15N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面关于13C、15N叙述正确的是( )
| A. | 13C与15N有相同的中子数 | B. | 15N与14N互为同位素 | ||
| C. | 13C与C60互为同素异形体 | D. | 15N的核外电子数与中子数相同 |