题目内容
18.甲、乙两人分别用不同的方法配制100mL 3.6mol/L的稀硫酸.(1)配制溶液时,一般可以分为以下几个步骤:
①称量或者量取 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为②①③⑧⑤⑥⑦④
(2)甲:量取18mol/L的浓硫酸20.0mL,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀.
①实验所用的玻璃仪器除烧杯和容量瓶外,还有玻璃棒、胶头滴管、量筒;
②使用容量瓶前必须进行的一步操作是检查是否漏水
③定容的正确操作是加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切
(3)乙:用100mL量筒量取20mL浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加水至100mL 刻度线,再搅拌均匀.
你认为此法是否正确?若不正确,指出其中错误之处不正确,不能用量筒配制溶液,不能将水加入到浓硫酸中.
分析 (1)根据配制步骤是计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器判断正确的操作顺序;
(2)根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸的体积;
①根据操作步骤选取实验仪器,判断缺少的仪器;
②带有玻璃塞的仪器均需要检漏;
③加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
(3)不能用量筒配制溶液;不能将水加入到浓硫酸中.
解答 解:(1)操作步骤有计算、量取、稀释、移液、洗涤、定容、摇匀等操作,所以正确的顺序为:②①③⑧⑤⑥⑦④;
故答案为:②①③⑧⑤⑥⑦④;
(2)设需要浓硫酸的体积为V,3.6mol/L×0.1L=18mol/L×V,V=0.02L=20.0mL;
故答案为:20.0;
①操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管),在烧杯中稀释,用玻璃棒搅拌,冷却后转移到100mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,故实验所用的玻璃仪器除烧杯和容量瓶外,还有玻璃棒、胶头滴管、量筒;
故答案为:玻璃棒、胶头滴管、量筒;
②带有玻璃塞的仪器均需要检漏,所以在使用容量瓶配制溶液必须进行的一步操作是检查是否漏水;
故答案为:检查是否漏水;
③定容的操作是:加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切,
故答案为:加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
(3)不能用量筒配制溶液,不能将水加入到浓硫酸中,故该做法不正确,
故答案为:不正确,不能用量筒配制溶液,不能将水加入到浓硫酸中.
点评 本题考查了一定物质的量浓度溶液的配制,侧重于考查学生的实验能力和对基础知识的综合应用能力,题目难度中等.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案| A. | 1 mol H2SO4的质量为98g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 6.02×1022个H2SO4分子的质量为9.8g | |
| D. | 9.8 g H2SO4含有6.02×1023个H2SO4分子 |
| A. | NO2 | B. | NaCl | C. | Na2S | D. | Na2O2 |
| A. | 称量时,将NaOH固体放在纸上 | |
| B. | 将称好的NaOH固体放入容量瓶中,加入少量水 | |
| C. | 在烧杯中溶解NaOH固体后,立即将溶液注入容量瓶中 | |
| D. | 将烧杯中已冷却的NaOH溶液注入未经干燥的容量瓶中 |
| A. | 60mL | B. | 45mL | C. | 30mL | D. | 无法计算 |
| A. | 该盐的名称为硝酸铵 | B. | 该盐的水溶液pH<7 | ||
| C. | 该盐的化学式为NH4HCO3 | D. | 该盐可做氮肥,不宜与草木灰混用 |

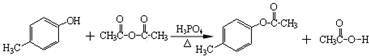 .
. .
. .
. )是一种重要的医药中间体.完成以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).
)是一种重要的医药中间体.完成以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选). $→_{一定条件}^{Cl_{2}}$
$→_{一定条件}^{Cl_{2}}$