题目内容
3.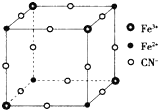 有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法错误的是( )
有一种蓝色晶体[可表示为:MFey(CN)6],经X射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上.其晶体中阴离子的最小结构单元如图所示.下列说法错误的是( )| A. | 该晶体的化学式为MFe2(CN)6 | |
| B. | 该晶体熔融可导电,且属于化学变化 | |
| C. | 该晶体属于离子晶体,M呈+2价 | |
| D. | 晶体中与每个Fe3+距离最近且等距离的CN-为6个 |
分析 由图可推出晶体中阴离子的最小结构单元中含Fe2+个数为:4×$\frac{1}{8}$=$\frac{1}{2}$,同样可推出含Fe3+个数也为$\frac{1}{2}$,CN-为12×$\frac{1}{4}$=3,因此阴离子为[Fe2(CN)6]-,则该晶体的化学式只能为MFe2(CN)6,由阴、阳离子形成的晶体为离子晶体,M的化合价为+1价,由图可看出与每个Fe3+距离最近且等距离的CN-为6个,据此答题.
解答 解:A、由图可推出晶体中阴离子的最小结构单元中含Fe2+个数为:4×$\frac{1}{8}$=$\frac{1}{2}$,同样可推出含Fe3+个数也为$\frac{1}{2}$,CN-为12×$\frac{1}{4}$=3,因此阴离子为[Fe2(CN)6]-,则该晶体的化学式只能为MFe2(CN)6,则该晶体的化学式只能为MFe2(CN)6,故A正确;
B、由阴、阳离子形成的晶体为离子晶体,晶体熔融可导电,发生电解,属于化学变化,故B正确;
C、由A的分析可知,晶体的化学式为MFe2(CN)6,根据化合价代数和为零可知,M的化合价为+1价,故C错误;
D、由图可看出与每个Fe3+距离最近且等距离的CN-为6个,故D正确;
故选C.
点评 本题考查了晶体的晶胞中原子个数的计算方法,如何根据晶体个数判断晶体中的晶胞个数,判断化合价和晶体类型,判断晶体中相邻原子个数等知识点.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
4.下列有关说法中不正确的是( )
| A. | Al(OH)3既能够与盐酸反应又能够与NaOH溶液反应 | |
| B. | 纤维素与淀粉互为同分异构体 | |
| C. | 纤维素能够与醋酸发生酯化反应 | |
| D. | 实验室中Al(OH)3可以由可溶性铝盐和氨水制备 |
11.已知 T、X、Y、Z 是中学化学常见的四种元素,其结构或性质信息如表:
请根据信息回答有关问题:
(1)写出这四种元素能形成的常见配体CN-、Cl-;(写两种)
(2)T、X、Y三种元素的由负性由大到小的顺序(填元素符号)是N>C>Na,第一电离能由大到小的顺序是N>C>Na;
(3)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2- 和四面体的[QZ4]2-,Q的配位数为4,其中Q与 Z 成键时中心原子采用的杂化方式是sp3.
| 元素 | 结构或性质信息 |
| T | 原子的L层上s电子数等于p 电子数 |
| X | 元素的原子半径是第三周期主族元素中最大的 |
| Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
| Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
(1)写出这四种元素能形成的常见配体CN-、Cl-;(写两种)
(2)T、X、Y三种元素的由负性由大到小的顺序(填元素符号)是N>C>Na,第一电离能由大到小的顺序是N>C>Na;
(3)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的外围电子排布式为3d84s2;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2- 和四面体的[QZ4]2-,Q的配位数为4,其中Q与 Z 成键时中心原子采用的杂化方式是sp3.
18.向等物质的量浓度的盐酸和NH4Cl混合溶液中逐滴加入NaOH溶液(加热),反应过程中,下列离子方程式与事实不相符的是( )
| A. | H++OH-═H2O | B. | H++NH4++2OH-═NH3↑+2H2O | ||
| C. | 4H++NH4++5OH-═NH3↑+5H2O | D. | H++2NH4++3OH-═2NH3↑+3H2O |
15.可逆反应:2NO2(g)?2NO(g)+O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率数值之比为2:2:1的状态
④混合气体的颜色不再改变的状态.
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率数值之比为2:2:1的状态
④混合气体的颜色不再改变的状态.
| A. | ①④ | B. | ②③ | C. | ①③④ | D. | ①②③④ |
12.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1L 0.1mol•L-1FeCl3溶液中含有的Fe3+离子数目为0.1NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA | |
| D. | 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1NA |
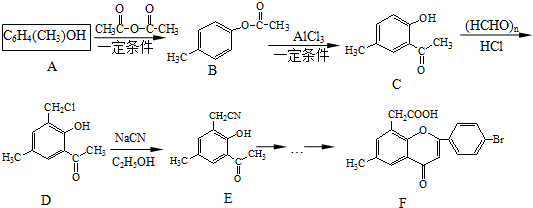
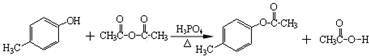 .
.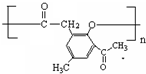 .
.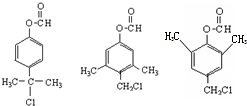 .
.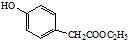 )是一种重要的医药中间体.完成以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).
)是一种重要的医药中间体.完成以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).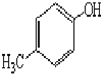 $→_{一定条件}^{Cl_{2}}$
$→_{一定条件}^{Cl_{2}}$