题目内容
6.(1)同分异构现象是有机化合物种类繁多的重要原因,正确识别和判断同分异构体是学习有机化学的重要能力.①下列分子式表示的物质中有同分异构体的是D.
A.CH4O B.C2H4 C.C2H5Cl D.C2H4O2
②利用核磁共振氢谱可判断出分子式为C2H6O的有机物有两种同分异构体,在核磁共振氢谱上有一种特征峰的有机物的结构简式是CH3OCH3.
③已知C4H9Cl共有四种结构,则分子式为C5H10O的醛有4种同分异构体.
(2)充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍,该有机物的分子式为C4H8.若该有机物没有甲基,则其结构简式为
 .
.
分析 (1)①CH4O、C2H2、C2H5Cl分别为甲醇、乙烯和氯乙烷,都不存在同分异构体,只有C2H4O2存在同分异构体;
②分子式为C2H6O的有机物有两种同分异构体,在核磁共振氢谱上有一种特征峰说明该物质分子中只含一种氢原子;
③C4H9Cl中Cl原子换为-Cl就得到分子式为C5H10O的醛,根据C4H9Cl的同分异构体判断分子式为C5H10O的醛的同分异构体;
(2)根据相对密度计算出A的相对分子量,然后根据n=$\frac{m}{M}$分别计算出A、二氧化碳、水的物质的量,根据质量守恒确定A的分子式;然后根据A分子中没有甲基确定其结构简式.
解答 解:(1)①CH4O为甲醇C2H4为乙烯、C2H5Cl为一氯乙烷,三种都只有1种结构,不存在同分异构体;C2H4O2可能为乙酸或甲酸甲酯,存在2种同分异构体,
故答案为:D;
②分子式为C2H6O的有机物有两种同分异构体,在核磁共振氢谱上有一种特征峰说明该物质分子中只含一种氢原子,该物质为甲醚,则符合条件的有机物结构简式为CH3OCH3,
故答案为:CH3OCH3;
③C4H9Cl中Cl原子换为-Cl就得到分子式为C5H10O的醛,C4H9Cl的同分异构体有4种则分子式为C5H10O的醛的同分异构体也有4种,
故答案为:4;
(2)有机物A蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56,则n(A)=$\frac{2.8g}{56g/mol}$=0.05mol,由原子守恒可知,n(C)=n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(H)=2n(H2O)=2×$\frac{3.6g}{18g/mol}$=0.4mol,故有机物分子中含有C原子数目为:$\frac{0.2mol}{0.05mol}$=4,含有H原子数目为:$\frac{0.4mol}{0.05mol}$=8,m(C)+m(H)=12g/mol×0.2mol+1g/mol×0.4mol=2.8g,说明A分子中不含O原子,则A的分子式为C4H8;
A的分子式为C4H8,可能为烯烃或环烷烃,若该有机物没有甲基,则A只能为环丁烷,其结构简式为 ,
,
故答案为:C4H8; .
.
点评 本题考查有机物结构与性质,题目难度中等,涉及同分异构体判断、分子式、结构简式确定的计算,明确常见有机物组成、结构与性质为解答关键,试题培养了学生的分析能力及综合应用能力.

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案| A. | FeS2 | B. | CaC2 | C. | BaO2 | D. | MgCl2 |
①高温
②低温
③高压
④低压
⑤加催化剂
⑥分离出Z
⑦增加X
⑧增加Y.
| A. | ①③⑤⑦ | B. | ②③⑤⑦ | C. | ②③⑥⑧ | D. | ②④⑥⑧ |
| A. | 苯和乙烯都能使溴水褪色,且反应原理相同 | |
| B. | 乙炔和苯均为不饱和烃,都只能发生加成反应 | |
| C. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 | |
| D. | 分别用乙烷和乙烯制备氯乙烷的反应类型完全相同 |
| A. | S的燃烧热为297.23 kJ/mol | |
| B. | 形成1 mol SO2的化学键所释放的总能量大于断裂1mol S(s)和1mol O2(g)的化学键所吸收的总能量 | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.23 kJ | |
| D. | 1mol SO2的总能量小于 1mol S(s)和1mol O2(g)的总能量 |
| A. | N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 | |
| D. | MgF2晶体中的化学键是共价键 |
| A. | 简单氢化物的稳定性X<Z<W | |
| B. | Y单质在一定条件下可以与氧化铁发生置换反应 | |
| C. | X、Y、W最高价氧化物的水化物两两之间能发生反应 | |
| D. | 室温下,0.1mol/L W的气态氢化物的水溶液的pH>1 |
| A. | 碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 | |
| B. | 酸性氧化物一定是非金属氧化物,非金属氧化物不一定是酸性氧化物 | |
| C. | 能够电离出H+的物质一定是酸 | |
| D. | 氧化钠和过氧化钠均能与酸反应生成盐和水,故二者都是碱性氧化物 |
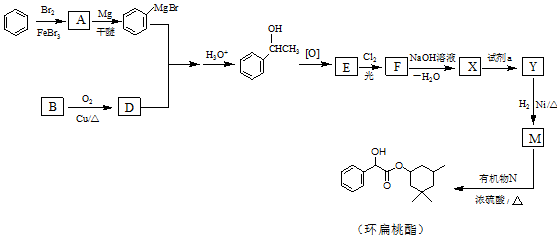
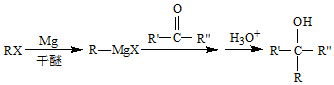 (R、R′、R″代表烃基或氢)
(R、R′、R″代表烃基或氢)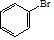 .
.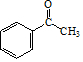 .
.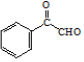 .
.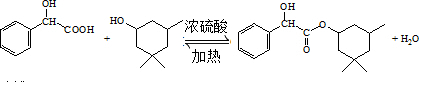 .
.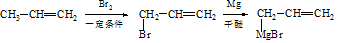
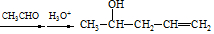
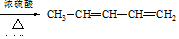 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).