题目内容
5. X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)
X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)(1)R位于元素周期表第四周期IB族(周期、族),Z的基态原子价层电子排布式为2s22p3.
(2)Z的气态氢化物比同族相邻元素的气态氢化物熔点高很多,其原因是NH3分子间形成氢键.
(3)X与Y可形成多种化合物,其中以直线型存在的4核分子中σ键与π键之比为3:2.
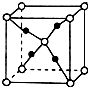
(4)R可以形成多种氧化物,其中一种的晶体结构如图,该氧化物的化学式为Cu2O,氧的配位数是4.
(5)可用YX4还原ZOx以消除污染.
YX4(g)+4ZO2(g)═4ZO(g)+YO2(g)+2X2O(g)△H=-574kJ?mol
YX4(g)+4ZO(g)═2Z2(g)+YO2(g)+2X2O(g)△H=-1160kJ/mol
试写出YX4还原ZO2至Z2的热化学方程式:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0KJ?mol.
分析 X的单质是密度最小的气体,则X为H元素;Y的一种核素常用于考古且其一种同素异形体是较软的物质之一,则Y为C元素;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟,则Z为N元素;R2+离子的3d轨道有9个电子,原子核外电电子排布式为1s22s22p63s23p63d104s1,则R为Cu,据此解答.
解答 解:X的单质是密度最小的气体,则X为H元素;Y的一种核素常用于考古且其一种同素异形体是较软的物质之一,则Y为C元素;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟,则Z为N元素;R2+离子的3d轨道有9个电子,原子核外电电子排布式为1s22s22p63s23p63d104s1,则R为Cu.
(1)R2+离子的3d轨道有9个电子,原子核外电电子排布式为1s22s22p63s23p63d104s1,处于周期表中第四周期IB族,Z为N元素,基态原子价层电子排布式为2s22p3,
故答案为:第四周期IB族;2s22p3;
(2)NH3分子间形成氢键,比同族相邻元素的气态氢化物熔点高很多,
故答案为:NH3分子间形成氢键;
(3)H与C可形成多种化合物,其中以直线型存在的4核分子为H-C≡C-H,分子中σ键与π键之比为 3:2,
故答案为:3:2;
(4)Cu可以形成多种氧化物,其中一种的晶体晶胞结构如图,晶胞中黑色球数目为4,白色球数目为1+8×$\frac{1}{8}$=2,原子数目之比为2:1,故为Cu2O,白色球为O,黑色球为Cu,氧的配位数是4,
故答案为:Cu2O;4;
(5)已知:①:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574.0KJ?mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) H=-1160.0KJ/mol
根据盖斯定律,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0KJ?mol,
故答案为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867.0KJ?mol.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对基础知识的理解掌握.

 阅读快车系列答案
阅读快车系列答案| A. | KClO3中的氯元素被氧化 | |
| B. | Cl2既是氧化剂,又是还原剂 | |
| C. | 还原剂是HCl | |
| D. | 每生成1mol Cl2转移电子的物质的量为6mol |
| A. | 常温常压下,11.2L CO2与8.5g NH3所含分子数相等 | |
| B. | 等质量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 同温同压下,相同体积的H2和CO2的原子数之比为2:3 | |
| D. | 同温同压下,相同质量的NO和C2H4(气体)体积相同 |
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
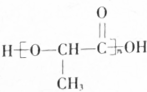 .合成N、F的路线如下:
.合成N、F的路线如下: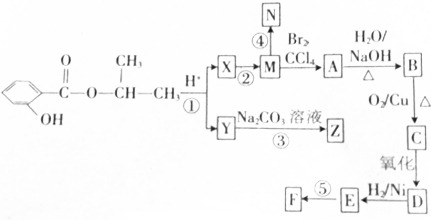
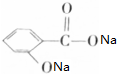 ,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇.
,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇. →
→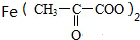 +H2↑.
+H2↑. 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
 .
.