题目内容
4.高分子化合物N、F是两种常用的塑料,其中由F形成的高分子材料具有生物兼容性,在自然环境中最终降解为CO2和H2O,被称为环境友好型高分子材料,F的结构简式是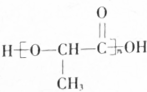 .合成N、F的路线如下:
.合成N、F的路线如下: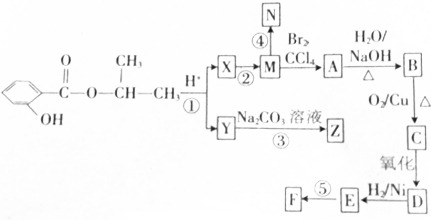
(1)E的结构简式是CH3CH(OH)COOH,Z的结构简式是
 ,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇.
,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇.(2)写出A→B的化学方程式:CH3CH(Br)CH2Br+2NaOH$→_{水}^{△}$CH3CH(OH)CH2OH+2NaBr.D与纯铁粉可制备一种药物,写出其反应的化学方程式Fe+2
 →
→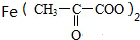 +H2↑.
+H2↑.
分析 根据题中各物质转化关系可知,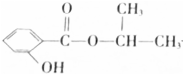 酸性水解得
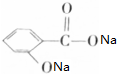
酸性水解得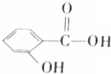 和CH3CH(OH)CH3,Y能碳酸钠反应,所以Y为
和CH3CH(OH)CH3,Y能碳酸钠反应,所以Y为 ,则X为CH3CH(OH)CH3,Y与碳酸钠反应生成Z为
,则X为CH3CH(OH)CH3,Y与碳酸钠反应生成Z为 ,由于M能在与溴发生反应且M能生成高分子化合物N,可以推知X发生消去反应生成M为CH3CH=CH2,M发生加聚反应生成N为
,由于M能在与溴发生反应且M能生成高分子化合物N,可以推知X发生消去反应生成M为CH3CH=CH2,M发生加聚反应生成N为 ,M与溴发生加成反应生成A为CH3CH(Br)CH2Br,A发生碱性水解得B为CH3CH(OH)CH2OH,B发生氧化反应得C为
,M与溴发生加成反应生成A为CH3CH(Br)CH2Br,A发生碱性水解得B为CH3CH(OH)CH2OH,B发生氧化反应得C为 ,C再氧化得D为
,C再氧化得D为 ,D与氢气加成得E为CH3CH(OH)COOH,E发生缩聚反应得F为
,D与氢气加成得E为CH3CH(OH)COOH,E发生缩聚反应得F为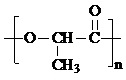
解答 解:根据题中各物质转化关系可知, 酸性水解得
酸性水解得 和CH3CH(OH)CH3,Y能碳酸钠反应,所以Y为
和CH3CH(OH)CH3,Y能碳酸钠反应,所以Y为 ,则X为CH3CH(OH)CH3,Y与碳酸钠反应生成Z为
,则X为CH3CH(OH)CH3,Y与碳酸钠反应生成Z为 ,由于M能在与溴发生反应且M能生成高分子化合物N,可以推知X发生消去反应生成M为CH3CH=CH2,M发生加聚反应生成N为
,由于M能在与溴发生反应且M能生成高分子化合物N,可以推知X发生消去反应生成M为CH3CH=CH2,M发生加聚反应生成N为 ,M与溴发生加成反应生成A为CH3CH(Br)CH2Br,A发生碱性水解得B为CH3CH(OH)CH2OH,B发生氧化反应得C为
,M与溴发生加成反应生成A为CH3CH(Br)CH2Br,A发生碱性水解得B为CH3CH(OH)CH2OH,B发生氧化反应得C为 ,C再氧化得D为
,C再氧化得D为 ,D与氢气加成得E为CH3CH(OH)COOH,E发生缩聚反应得F为
,D与氢气加成得E为CH3CH(OH)COOH,E发生缩聚反应得F为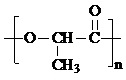
(1)根据上面的分析可知,E的结构简式是 CH3CH(OH)COOH,Z为 ,X为CH3CH(OH)CH3,与X具有相同官能团的一种同分异构体为CH3CH2CH2OH,其名称为:1-丙醇,
,X为CH3CH(OH)CH3,与X具有相同官能团的一种同分异构体为CH3CH2CH2OH,其名称为:1-丙醇,
故答案为:CH3CH(OH)COOH; ;1-丙醇;
;1-丙醇;
(2)A为CH3CH(Br)CH2Br,B为CH3CH(OH)CH2OH,A→B的化学方程式为CH3CH(Br)CH2Br+2NaOH$→_{水}^{△}$CH3CH(OH)CH2OH+2NaBr,D为 ,D与纯铁粉反应的化学方程式为Fe+2
,D与纯铁粉反应的化学方程式为Fe+2 →
→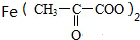 +H2↑,
+H2↑,
故答案为:CH3CH(Br)CH2Br+2NaOH$→_{水}^{△}$CH3CH(OH)CH2OH+2NaBr;Fe+2 →
→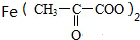 +H2↑.
+H2↑.
点评 本题考查有机物的推断,需要对给出反应信息要求学生加以应用,能较好的考查考生的阅读、自学能力和思维能力,是热点题型,结合反应条件与官能团的性质进行解答,难度中等.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案| A. | 相同质量的N4、N5分子其原子数之比为5:4 | |
| B. | N5、N4与N2互为同素异形体 | |
| C. | N4、N5均属于新型的化合物 | |
| D. | N5的摩尔质量为70 |
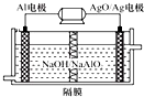
| A. | 由非电解质溶于水得到的溶液 | |
| B. | [H+]、[OH-]均为5.0×10-7mol•L-1的溶液 | |
| C. | 等物质的量的强酸与强碱反应得到的溶液 | |
| D. | 将pH=9的烧碱溶液稀释100倍所得到的溶液 |
| A. | 25℃时NH4Cl溶液的Kw大于100℃时NH4Cl溶液的Kw | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO42-+2I- | |
| C. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加入等体积0.3mol•L-1NaOH溶液 | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉至蓝色刚好消失后过滤 | |
| C. | 配制1mol/LMgSO4溶液:将12.0gMgSO4固体倒进100mL容量瓶中,然后加入100mL蒸馏水 | |
| D. | 确定Na2CO3溶液中是否混有NaOH:取少量溶液滴加过量BaCl2溶液,过滤取滤液,在滤液中滴加酚酞,观察是否出现红色 |
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.

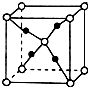 X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)
X、Y、Z、R是元素周期表中前四周期中的常见元素.X的单质是密度最小的气体;Y的一种核素常用于考古,且其一种同素异形体是较软的物质之一;Z的气态氢化物与其最高价氧化物的水化物相遇会产生大量白烟;R2+离子的3d轨道有9个电子.(答题时用具体的元素符号)