题目内容
7.下列各组溶液中离子,能在溶液中大量共存且溶液为澄清透明的是( )| A. | K+、Cu2+、NO3-、OH- | B. | K+、Na+、Cl-、NO3- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | Fe3+、K+、NO3-、SO42- |
分析 A.铜离子与氢氧根离子反应生成氢氧化铜沉淀;
B.四种离子之间不反应,为澄清透明溶液;
C.银离子与氯离子之间反应生成氯化银沉淀;
D.四种离子之间不发生反应,能够共存.
解答 解:A.Cu2+、OH-之间反应生成难溶物氢氧化铜,在溶液中不能大量共存,故A错误;
B.K+、Na+、Cl-、NO3-之间不发生反应,在溶液中能够大量共存,故B正确;
C.Ag+、Cl-之间反应生成氯化银沉淀,在溶液中不能大量共存,故C错误;
D.Fe3+、K+、NO3-、SO42-之间不反应,在溶液中能够大量共存,故D正确;
故选BD.
点评 本题考查离子共存的判断,为高考的高频题,题目难度不大,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.根据表中键能数据.计算反应HC1(g)=$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)的△H=+91.5kJ/mol.
| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能 | 436 | 243 | 431 |
15.如图是从元素周期表中截取下来的,A、B、C为短周期主族元素,下列说法中正确的是( )
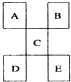

| A. | D一定足金属元素,其金属性比C强 | |
| B. | C的最高价氧化物水化物显强酸性 | |
| C. | E的原子序数一定是A的5倍,且原予半径比A大 | |
| D. | B的氢化物是以分子形式存在,且分子间存在氢键 |
19.已知可逆反应:N2(g)+3H2(g)?2NH3(g),下列关于此反应的说法中错误的是( )
| A. | 增大N2的浓度可使该反应的反应速率加快 | |
| B. | 升高温度,该反应的反应速率加快 | |
| C. | 将1 mol N2和3 mol H2混合进行反应,反应完成时得到2 mol NH3 | |
| D. | 单位时间内生成1 mol N2,同时消耗3 mol H2,说明该反应达到平衡状态 |
16.下列第三周期的元素中,原子半径最小的是( )
| A. | S | B. | F | C. | Na | D. | O |
17.将 E 和 F 加入密闭容器中,在一定条件下发生反应:2E(g)+F(s)?G(g).忽略固体体积,平衡时 E的体积分数(%)随温度和压强的变化如下表所示.下列推断不正确的是( )
 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 915℃,2.0 MPa 时 E 的转化率为 60% | |
| B. | K(810℃)>K(1000℃) | |
| C. | 该反应可在较低温度下自发进行 | |
| D. | e>d |