题目内容
在碱性溶液中能大量共存且为无色透明溶液的是( )
| A、K+ Cl- MnO4- SO42- |
| B、Ca2+ CO32- NO3- SO42- |
| C、Na+ HCO3- NO3- SO42- |
| D、Na+ SO42- NO3- Cl- |
考点:离子共存问题
专题:离子反应专题
分析:某强碱性溶液中,含大量的OH-,根据离子之间不能结合生成水、气体、沉淀等,不能发生氧化还原反应等,离子大量共存,并结合离子的颜色来解答.
解答:
解:A.MnO4-有颜色,不符合题目无色要求,故A错误;
B.Ca2+与CO32-反应生成沉淀而不能大量共存,故B错误;
C.碱性条件下HCO3-不能大量共存,故C错误;
D.离子之间不发生任何反应,可大量共存,故D正确.
故选D.
B.Ca2+与CO32-反应生成沉淀而不能大量共存,故B错误;
C.碱性条件下HCO3-不能大量共存,故C错误;
D.离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查离子共存,为高频考点,把握习题中的信息及离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,注意归纳常见离子的颜色,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
用已被部分氧化的金属屑A制备某工业常用盐C的步骤如下:将C溶于水,向其中滴入NaOH溶液,出现白色沉淀,后逐渐变为红褐色,下列判断正确的是( )
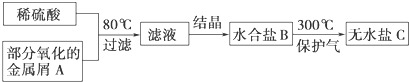

| A、过滤所得的残渣中一定没有金属A |
| B、滤液可能是CuSO4溶液或MgSO4溶液 |
| C、水合盐B可能是FeSO4?7H2O |
| D、无水盐C可能是Fe2(SO4)3 |
如图是制取气体的一种装置,能用此装置制取气体并能“随开随用,随关随停”的是( )


| A、二氧化锰与浓盐酸制Cl2 |
| B、过氧化钠与水制O2 |
| C、锌与稀硫酸制H2 |
| D、电石与水制取C2H2 |
两种金属组成的合金5.6g,与氯气完全反应,消耗氯气7.1g,则合金的组成可能( )
| A、Cu和Zn |
| B、Al和Zn |
| C、Al 和 Na |
| D、Cu和Fe |
NaCl是一种重要的化工原料,如图所示,可以制备一系列物质.下列说法正确的是( )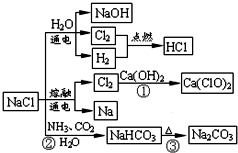

| A、反应②③是侯氏制碱法的原理 |
| B、反应①中的Ca(ClO)2是还原产物 |
| C、常温下干燥Cl2可储存于钢瓶中,所以Cl2与铁不反应 |
| D、图中所示转化反应都是氧化还原反应 |
下列有关电解质溶液中粒子浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② |
| D、NaHCO3溶液中:c(Na+)>c( HCO3-)>c(OH-)>c(H+)>c(CO32-) |
室温下,甲、乙两烧杯均盛有5mLpH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙两烧杯中溶液的描述正确的是( )
| A、水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
| B、溶液的体积:10V甲≤V乙 |
| C、若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 |
| D、若分别与5mLpH=11的NaOH溶液反应,所得溶液的pH:甲≥乙 |
下列说法正确的是( )
| A、增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| B、恒容容器中平衡体系A(g)?2B(g)中增加A的物质的量,A的转化率增大 |
| C、一定条件下反应2AB(g)?A2(g)+B2(g),当容器中各组分的体积分数不随时间变化,说明体系达到平衡状态 |
| D、已知反应A2(g)+2B2(g)?2AB2(g)△H<0,升高温度,正向反应速率增加,逆向反应速率减小 |



