题目内容
3.某研究性学习小组的成员经过学习得知,Cl2与H2O发生下列化学反应:Cl2+H2O═HCl+HClO,并且HClO具有比Cl2更强的氧化性.为了探究新制饱和氯水的组成和性质而进行了科学实验.先观察氯水的外观,然后用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,边滴边振荡,观察现象,发现溶液的红色逐渐褪去而得到无色溶液.请回答下列问题:(1)写出新制饱和氯水中含有氯元素的粒子Cl2、HCl(或Cl-)、HClO.
(2)若不再进行更多的实验,请说明能快速判断氯水中含有Cl2的主要依据氯水显浅黄绿色.
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字说明:
①HCl中和了NaOH;
②HClO氧化了酚酞.
(4)他们要通过实验进一步探究溶液红色褪色的原因究竟是上述中的①还是②,在此之前先做了实验预案的设计.请简述实验的方法、现象和结论:取适量无色溶液于洁净的试管中,加2滴氢氧化钠溶液,振荡,观察现象,若溶液呈现红色,则证明溶液红色褪去的原因是①不是②;若溶液仍为无色,则证明溶液红色褪去的原因是②不是①.
分析 (1)根据氯气和水反应的方程式确定含氯元素的粒子;
(2)氯气的颜色是黄绿色,根据氯水的颜色判断是否含有氯气;
(3)含有酚酞的红色NaOH溶液,利用氯水中含有盐酸和次氯酸来分析;
(4)对褪色的溶液,若再加碱,恢复红色,则褪色是酸碱中和的原因;若再加碱,仍为无色,则是HClO的强氧化性的原因使溶液红色褪去.
解答 解:(1)因氯气和水反应生成盐酸和次氯酸,盐酸为强酸完全电离,次氯酸为弱酸部分电离,所以饱和氯水中含有氯元素的粒子为Cl2、Cl-、HClO、ClO-,
故答案为:Cl2、Cl-、HClO、ClO-;
(2)因氯气为黄绿色气体,氯水为浅黄绿色,则氯水显浅黄绿色能证明氯水中含有Cl2,
故答案为:氯水显浅黄绿色;
(3)因碱遇酚酞变红,氯水中有盐酸,盐酸与碱发生中和反应,HCl中和了NaOH,则红色褪去,氯水中还有次氯酸,次氯酸具有强氧化性,HClO氧化了酚酞而使红色褪色,
故答案为:HCl中和了NaOH;HClO氧化了酚酞;
(4)对褪色的溶液,取试管内的无色溶液3mL盛于另一支洁净的试管中,再向试管内滴加2滴NaOH溶液振荡后发现恢复红色,则证明溶液红色褪去的原因是①而不是②;
若再加碱,仍为无色,则证明溶液红色褪去的原因是②而不是①.
故答案为:取适量无色溶液于洁净的试管中,加2滴氢氧化钠溶液,振荡,观察现象,若溶液呈现红色,则证明溶液红色褪去的原因是①不是②;若溶液仍为无色,则证明溶液红色褪去的原因是②不是①.
点评 本题为实验探究习题,同时考查氯水的成分、氯气、次氯酸的性质,明确溶液显红色和红色褪去的可能性是解答本题的关键,难度不大,注重了基础知识的考查.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | 摩尔是联系宏观和微观的物理量 | |
| B. | Na的摩尔质量为23g/mol | |
| C. | 非标准状况下气体摩尔体积不可能为22.4 L | |
| D. | 1mol氢的质量为2g |
6.下列说法错误的是( )
| A. | 向0.1mol•L-1CH3COOH溶液中加入少量CH3COONH4固体,溶液的pH增大 | |
| B. | 一定温度下,将pH=a的氨水溶液稀释10倍后,其pH=b,则a=b+1 | |
| C. | 浓度均为0.1mol•L-1的HCN溶液和NaCN溶液等体积混合(忽略体积变化),溶液中c(HCN)+c(CN-)=0.1mol•L-1 | |
| D. | 室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10mol•L-1 |
10. 短周期主族元素X、Y、Z、W的原子序数依次增大.在图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0.01mol•L-1v溶液的pH均为2.
短周期主族元素X、Y、Z、W的原子序数依次增大.在图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0.01mol•L-1v溶液的pH均为2.
下列说法正确的是( )
 短周期主族元素X、Y、Z、W的原子序数依次增大.在图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0.01mol•L-1v溶液的pH均为2.
短周期主族元素X、Y、Z、W的原子序数依次增大.在图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0.01mol•L-1v溶液的pH均为2.下列说法正确的是( )
| A. | 原子半径:r(X)<r(Z)<r(Y) | |
| B. | 简单氢化物的稳定性:Y>Z>W | |
| C. | W的氧化物的水化物的酸性一定比Y的强 | |
| D. | X、Y、Z三种元素形成的化合物只能抑制水的电离 |
8.下列物质的水溶液因水解而呈酸性的是( )
| A. | NH4Cl | B. | Na2SO4 | C. | NaHCO3 | D. | Ba(NO3)2 |
12.关于SO2的叙述中正确的是( )
| A. | 它可使石蕊试液褪色 | |
| B. | 通入BaCl2溶液中,生成白色沉淀 | |
| C. | SO2通入氢氧化钠与酚酞的混合溶液中红色变浅直至褪去 | |
| D. | 等物质的量的Cl2和SO2通入品红溶液中,品红溶液褪色 |
13.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.5mol/LFe2(SO4)3溶液中,SO42-的数目为1.5NA | |
| B. | 7.1gCl2与足量NaOH溶液反应转移的电子数为0.2NA | |
| C. | 5.6 g铁与0.1 mol氯气充分反应转移电子数为 0.2NA | |
| D. | 在0.1mol蓝矾晶体和1L 0.1moL•L-1AlCl3溶液中,金属阳离子总数均小于0.1NA |
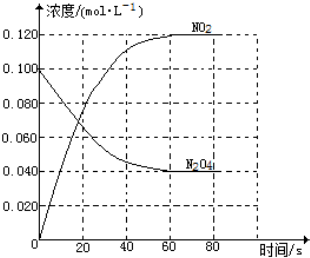 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.