题目内容
工业上利用可逆反应N2(g)+3H2(g)?2NH3(g)合成氨,下列叙述正确的是( )
| A、恒温恒压条件下混合气体相对密度不再改变可以说明该反应已经达平衡状态 |
| B、恒容通入氩气,使反应体系的压强增大,反应速率必定增大 |
| C、该反应是放热反应,降低温度将缩短反应达到平衡的时间 |
| D、随着反应的进行,逆反应速率逐渐增大,正反应速率逐渐减小最后为0 |
考点:化学平衡的调控作用,化学平衡状态的判断
专题:化学平衡专题
分析:A.恒温恒压条件下混合气体相对密度不再改变,说明容器体积不再改变,气体的总物质的量不再改变;
B.恒容通入氩气,容器的体积不变,反应气体的浓度不变;
C.降低温度,反应速率减小;
D.达到平衡时,正逆反应速率相等,但不为0.
B.恒容通入氩气,容器的体积不变,反应气体的浓度不变;
C.降低温度,反应速率减小;
D.达到平衡时,正逆反应速率相等,但不为0.
解答:
解:A.恒温恒压条件下混合气体相对密度不再改变,说明容器体积不再改变,气体的总物质的量不再改变,可说明达到平衡状态,故A正确;
B.恒容通入氩气,容器的体积不变,反应气体的浓度不变,反应速率不变,故B错误;
C.降低温度,反应速率减小,故C错误;
D.可逆反应的平衡为动态平衡,达到平衡时,正逆反应速率相等,但不为0,故D错误.
故选A.
B.恒容通入氩气,容器的体积不变,反应气体的浓度不变,反应速率不变,故B错误;
C.降低温度,反应速率减小,故C错误;
D.可逆反应的平衡为动态平衡,达到平衡时,正逆反应速率相等,但不为0,故D错误.
故选A.
点评:本题考查较为综合,涉及化学反应速率的影响、化学平衡的移动以及平衡状态等知识,为高考常见题型,侧重于学生的分析能力的考查,注意把握相关知识的积累,难度不大.

练习册系列答案
相关题目
某同学组装了如图所示的电化学装置.电极I为Al,其他电极均为Cu,则( )


| A、工作一段时间后,C烧杯的PH减小 |
| B、电极I发生还原反应 |
| C、盐桥中的K+移向A烧杯 |
D、电流方向:电极Ⅳ→ →电极I →电极I |
下列说法中不正确的是( )
| A、光导纤维、硝化纤维、铜氨纤维、玻璃纤维的主成分都是糖类 |
| B、生理盐水、葡萄糖注射液都不能产生丁达尔效应现象,不属于胶体 |
| C、红外光谱仪可用于测定化合物的官能团、1H核磁共振仪可确定H所处的化学环境 |
| D、用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的 |
氧化还原反应与四种基本类型反应的关系如图所示,则下列属于3区域的是( )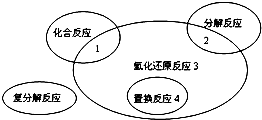

| A、Fe+CuSO4=FeSO4+Cu | ||||
B、2KMnO4
| ||||
| C、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
| D、2Na2O2+2CO2=2Na2CO3+O2 |
下列有关实验的说法不正确的是( )
| A、当沉淀的颗粒较大时,也可用倾析法将固体和溶液分离 |
| B、结晶时,若溶质的溶解度越小,或溶液的浓度越高、或溶剂的蒸发速度越快,析出的晶粒就越细小 |
| C、硫酸亚铁铵晶体过滤后用无水乙醇洗涤而不要用水洗涤主要是为了减少晶体损失 |
| D、阿司匹林制备实验中,将粗产品加入饱和NaOH溶液中以除去水杨酸聚合物 |
欲将蛋白质从水中析出而又不变性,应加入( )
| A、饱和Na2SO4溶液 |
| B、福尔马林溶液 |
| C、18.4 mol/L的硫酸溶液 |
| D、1.0mol/L的CuSO4溶液 |
某无色透明溶液中存在大量的H+、Cl-、NO3-,该溶液中还可能大量存在的是( )
| A、HCO3- |
| B、NH4+ |
| C、Cu2+ |
| D、Ag+ |