题目内容
14.酸性KMnO4溶液能与草酸(H2C2O4)溶液反应.某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素.Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的化学方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
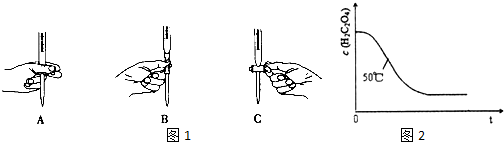
(2)滴定过程中操作滴定管的图1示正确的是A.
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的草酸溶液浓度偏高(填“偏高”、“偏低”、或“不变”).
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol•L-1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究探究温度不同对反应速率的影响; b.实验1和3探究反应物浓度对该反应速率的影响; c.实验1和4探究催化剂对该反应速率的影响. | |
| 体积 (mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(5)该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4而不是MnCl2,原因可用离子方程式表示为2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
分析 Ⅰ.(1)高锰酸钾具有强氧化性,草酸(H2C2O4)溶液与酸性KMnO4溶液发生氧化还原反应,草酸被氧化为二氧化碳,高锰酸钾被还原为Mn2+;
(2)根据滴定管的使用规则判断,选择酸式滴定管,滴定时用左手的大拇指、食指、中指旋转滴定管的旋塞;
(3)若滴定前滴定管尖嘴处有气泡,滴定后消失,会使高锰酸钾溶液的体积偏大,使得测得的草酸的物质的量偏大,溶液浓度偏高;
Ⅱ.实验1、2只有温度不同,其他用量完全相同;
(4)根据温度降低反应速率减小画出25℃时c(C2O42-)~t的变化曲线示意图;
(5)根据表格中的褪色时间长短来判断浓度大小与反应速率的关系,高锰酸钾的物质的量相同,浓度不同的草酸溶液,可以探究反应物浓度对该反应速率的影响;
(6)酸性条件下,高锰酸根离子能将氯离子氧化成氯气,自身被还原成二价锰离子.
解答 解:Ⅰ.(1)高锰酸钾具有强氧化性,把草酸中的C从+3价氧化成+4价的二氧化碳,Mn元素从+7价变化到+2价的锰离子,由于草酸分子中有2个C原子,所以高锰酸钾与草酸的反应比例为 5:2,故反应的方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)酸性高锰酸钾氧化性强,所以在该实验中选择酸式滴定管,根据滴定管的使用规则,滴定时,左手包住滴定管的活塞控制液滴的滴出,防止活塞被意外打开,即如图A所示操作;
故答案为:A;
(3)若滴定前滴定管尖嘴处有气泡,对初读数无影响,但滴定后消失,会使末读数偏大,二者的差值为酸性高锰酸钾溶液滴定的体积,导致计算出的草酸溶液的浓度偏高,
故答案为:偏高;
Ⅱ.实验1、2反应物用量完全相同,只有温度不同,目的就在于探究温度不同对反应速率的影响;
故答案为;探究温度不同对反应速率的影响;
(4)25℃时反应速率小于50℃时,所以草酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(C2O42-)~t的变化曲线示意图为: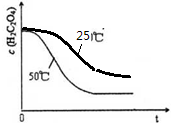 ,
,
故答案为: ;
;
(5)探究反应物浓度对速率影响时应在其他条件不变时改变某种反应物的浓度,在本实验中褪色的是酸性高锰酸钾溶液,所以酸性高锰酸钾的溶液的体积、浓度 应是不能变的,而只改变草酸的浓度(体积不变),观察溶液褪色的时间,所以其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间,
故答案为:其它条件相同时,利用等量且少量的高锰酸钾与等体积不同浓度的足量草酸溶液反应,测量溶液褪色时间;
(6)该实验中使用的催化剂应选择MnSO4而不是MnCl2,是因为氯离子与酸性高锰酸钾溶液发生氧化还原反应 而生成氯气,消耗酸性高锰酸钾溶液,使滴定结果偏高,发生的离子方程式是2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O,
故答案为:2MnO4-+10Cl-+16H+=5Cl2↑+2Mn2++8H2O.
点评 本题考查了探究温度、浓度对反应速率的影响、浓度岁时间变化的曲线,题目难度中等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | a+8+m-n | B. | a+16-m+n | C. | a+24-m-n | D. | a+18-m-n |
| A. | 变化的化学方程式是:NaCl03+KCl=KClO3(结晶)+NaCl | |
| B. | KClO3是难溶物 | |
| C. | KClO3是比NaClO3更弱的电解质 | |
| D. | 相同温度下,KCl03的溶解度比NaCl03小 |
 某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:
某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:| 实验 序号 | 锌的质量/g | 锌的 状态 | c(H2SO4)/mol•L-1 | V(H2SO4) /mL | 反应前溶液的温度/℃ | 添加剂 |
| 1 | 0.65 | 粒状 | 0.5 | 50 | 20 | 无 |
| 2 | 0.65 | 粉末 | 0.5 | 50 | 20 | 无 |
| 3 | 0.65 | 粒状 | 0.5 | 50 | 20 | 2滴CuSO4溶液 |
| 4 | 0.65 | 粉末 | 0.8 | 50 | 20 | 无 |
| 5 | 0.65 | 粉末 | 0.8 | 50 | 20 | 2滴CuSO4溶液 |
(2)对锌和稀硫酸反应,实验1和2表明,固体反应物的表面积对反应速率有影响;实验1和3表明,(是否形成)原电池对反应速率有影响.
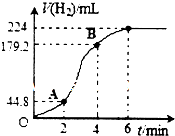
(3)进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图象如右图所示.
①在OA、AB、BC三段中反应速率最快的是AB,原因是反应放热,使温度升高,反应速率加快.
②2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=0.06mol•L-1•min-1.
| A. | 碱金属的密度随着原子序数的递增逐渐减小 | |
| B. | 钾与氧气或水反应比钠与氧气或水反应剧烈,铷、铯的相应反应更剧烈 | |
| C. | 随着原子序数的递增碱金属单质的熔沸点升高 | |
| D. | 碱金属元素阳离子的氧化性随着原子序数的递增依次增强 |
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正价依次升高 | |
| C. | N、O、F原子得电子能力减弱 | |
| D. | Na、K、Rb的电子层数逐渐增多 |
| A. | 金属钠与固态水分别受热熔化 | B. | 氯化铵与苯分别受热变为气体 | ||
| C. | 氯化钠与氯化氢分别溶解在水中 | D. | 碘与干冰分别受热变为气体 |
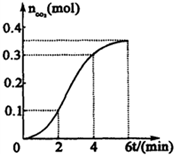 为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题:
为了研究CaCO3与稀盐酸反应的反应速率,某学生将少量CaCO3颗粒加入到500mL浓度为 2.0mol/L的稀盐酸中,通过实验测定:在标准状况下放出气体的物质的量(标准状况下)和时间的关系如图所示.请依图回答下列问题: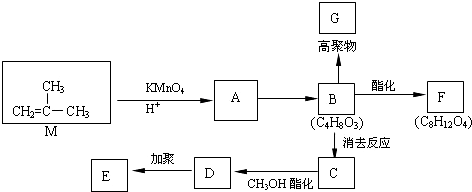
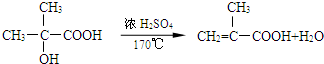 .②D→E的化学方程式
.②D→E的化学方程式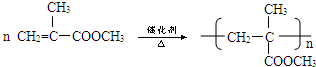 .
. ,
, 等.
等.