题目内容
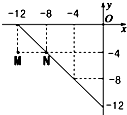 某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:
某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:①M、N点对应的温度分别是T1、T2,则T1
②T2时,水的离子积常数Kw=
考点:水的电离
专题:
分析:①从图中数据分别计算M点与N点的离子积常数=c(H+).c(OH-),然后依据水电离是吸热反应判断大小;
②依据该温度,计算水的离子积,利用此离子积结合pH=9,计算氢离子浓度,氢离子此时全部来源于水的电离.
②依据该温度,计算水的离子积,利用此离子积结合pH=9,计算氢离子浓度,氢离子此时全部来源于水的电离.
解答:
解:①根据图知:N点对应:当c(H+)=10-8 mol/L,c(OH-)=10-4 mol/L,由离子积常数=c(H+).c(OH-)=10-8×10-4=10-12,M点对应:当c(H+)=10-12 mol/L,c(OH-)=10-4 mol/L,由离子积常数=c(H+).c(OH-)=10-12×10-4=10-16,即N点对应水的离子积>M点对应水的离子积,水的电离为吸热反应,故T1<T2,故答案为:<;
②该温度下,水的离子积常数为:10-16,氢氧化钠溶液中氢离子浓度=10-9,氢离子全部来源于水的电离,故答案为:10-9.
②该温度下,水的离子积常数为:10-16,氢氧化钠溶液中氢离子浓度=10-9,氢离子全部来源于水的电离,故答案为:10-9.
点评:本题考查了离子积常数的有关计算,水的离子积只与温度由于,注意纯水中氢离子浓度等于氢氧根离子浓度,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知H-H,H-O,和O═O键的键能分别为436KJ.mol-1,463KJ.mol-1,495KJ.mol-1,下列热化学方程式正确的是( )
A、H2O(g)═H2(g)+1
| ||
B、H2O(g)═H2(g)+
| ||
| C、2 H2(g)+O2(g)═2 H2O(g)△H=+485 KJ.mol-1 | ||
| D、2 H2(g)+O2(g)═2 H2O(g)△H=-485 KJ.mol-1 |
下列说法正确的是( )
| A、已知PM2.5是指大气中直径≤2.5×10-6 m的颗粒物则PM为2.5的大气一定能产生丁达尔效应 | ||||
| B、根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质 | ||||
| C、根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | ||||
D、
|
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )


| A、溴酸银的溶解是放热过程 |
| B、温度升高时溴酸银溶解速度加快 |
| C、60℃时溴酸银的KSP约等于6.25×10-4 |
| D、若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
当光束通过豆浆时,可观察到丁达尔效应,表明豆浆是( )
| A、胶体 | B、溶液 |
| C、悬浊液 | D、乳浊液 |
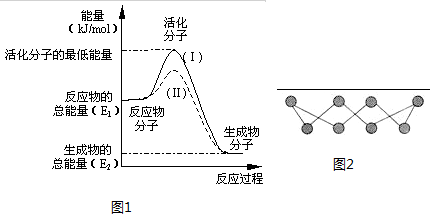 在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图1然后回答问题.
在化学反应中,只有能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示.请认真观察图1然后回答问题.