题目内容
将一定量N2与H2(体积比1:3)的混合气体通入合成塔,反应达到平衡后,NH3的体积分数为0.12(12%),则平衡混合气体中N2的体积分数为多少?H2的转化率为多少?
考点:化学平衡的计算
专题:
分析:根据三段法列式计算;
根据
计算N2的转化率.
根据
| N2的转化量 |
| N2的总量 |
解答:
解:(1)N2+3H2?2NH3
起始(mol)1 3 0
变化(mol)x 3x 2x
平衡(mol)1-x 3-3x 2x
则
=12%,x=
,
平衡时N2占平衡混合气体的体积百分比为
×100%=22%,平衡时H2占平衡混合气体的体积百分比为
=66%,
到达平衡时N2的转化率为
=21.4%,
答:平衡时N2和H2占平衡混合气体的体积百分比分别为22%和66%;到达平衡时N2的转化率为21.4%.
起始(mol)1 3 0
变化(mol)x 3x 2x
平衡(mol)1-x 3-3x 2x
则
| 2x |
| (1-x)+(3-3x)+2x |
| 6 |
| 28 |
平衡时N2占平衡混合气体的体积百分比为
| 1-x |
| 1-x+3-3x+2x |
| 1-x |
| 1-x+3-3x+2x |
到达平衡时N2的转化率为
| x |
| 1 |
答:平衡时N2和H2占平衡混合气体的体积百分比分别为22%和66%;到达平衡时N2的转化率为21.4%.
点评::本题考查了化学平衡的计算应用,根据化学平衡的三段式计算即可,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程如图.盐卤
Mg(OH)2
MgCl2溶液
MgCl2?6H2O
MgCl2
Mg下列说法错误的是( )
| 足量的石灰浆 |
| 操作① |
| 适量盐酸 |
| 操作② |
| HCl气流 |
| 操作③ |
| 电解 |
| 操作④ |
| A、操作①发生的反应为非氧化还原反应 |
| B、若在实验室进行操作①只需要漏斗和烧杯两种玻璃仪器 |
| C、操作②是蒸发浓缩、冷却结晶 |
| D、在整个制备过程中,未发生置换反应 |
在BaCl2溶液中通入SO2气体,溶液仍澄清.将BaCl2溶液分别盛入两支试管中,一支加氨水,另一支加硝酸溶液,然后再通入SO2,结果两试管都有白色沉淀.由此得出的下列结论中合理的是( )
| A、BaCl2有两性 |
| B、两支试管的白色沉淀均是亚硫酸钡 |
| C、SO2有还原性和酸性氧化物的通性 |
| D、以上说法均不合理 |
将过量的氯气通入溴化钠溶液中,再向溶液中加入一定量的CCl4,充分振荡,观察到的现象是( )
| A、溶液有无色变橙色 |
| B、上层几乎无色,下层显橙色 |
| C、溶液由橙色变无色 |
| D、上层无色,下层为紫色 |
一般硫粉含有S(单斜)和S(正交)两种同素异形体.已知常温下:
S(单斜)+O2(g)=SO2(g)△H=-297.16kJ/mol;
S(正交)+O2(g)=SO2(g)△H=-296.83kJ/mol
下列说法错误的是( )
S(单斜)+O2(g)=SO2(g)△H=-297.16kJ/mol;
S(正交)+O2(g)=SO2(g)△H=-296.83kJ/mol
下列说法错误的是( )
| A、S(g)+O2(g)=SO2(g)△H<-297.16 kJ/mol |
B、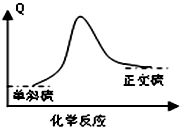 单斜硫转变为正交硫的能量变化可用图表示 |
| C、常温下正交硫比单斜硫稳定 |
| D、单斜硫转化为正交硫的反应是放热反应 |
下列说法正确的是(NA代表阿伏加德罗常数)( )
| A、22.4 L氨气中含氢原子数目为3 NA |
| B、5.6 g铁与足量盐酸反应产生的氢分子数为0.2NA |
| C、标准状况下,4.48 L的氧气和氮气的混合物含有的分子数目为0.2 NA |
| D、80 g苛性钠溶于1L水中,所得溶液的物质的量浓度为2 mol/L |
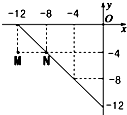 某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:
某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示: