题目内容
下列各组物质不用任何外加试剂,只用胶头滴管和试管就能鉴别的是( )
| A、AgNO3溶液和NaCl溶液 |
| B、BaCl2溶液和KHSO4溶液 |
| C、NaHCO3溶液和盐酸 |
| D、Na2CO3溶液和盐酸 |
考点:物质的检验和鉴别的基本方法选择及应用
专题:
分析:只用试管和胶头滴管就可以对下列各组中的两种溶液进行鉴别,则物质之间添加顺序不同,发生反应产生的现象不同,以此来解答.
解答:
解:A.AgNO3溶液和NaCl溶液改变加入顺序均生成白色沉淀,现象相同,不能鉴别,故A错误;
B.BaCl2溶液和KHSO4溶液改变加入顺序均生成白色沉淀,现象相同,不能鉴别,故B错误;
C.NaHCO3溶液和盐酸改变加入顺序均有气体生成,现象相同,不能鉴别,故C错误;
D.NaCO3溶液滴入盐酸中,立即产生气体,若将盐酸滴入NaCO3溶液中,开始没有气体生成,后有气体生成,二者显现不同,可鉴别,故D正确.
故选D.
B.BaCl2溶液和KHSO4溶液改变加入顺序均生成白色沉淀,现象相同,不能鉴别,故B错误;
C.NaHCO3溶液和盐酸改变加入顺序均有气体生成,现象相同,不能鉴别,故C错误;
D.NaCO3溶液滴入盐酸中,立即产生气体,若将盐酸滴入NaCO3溶液中,开始没有气体生成,后有气体生成,二者显现不同,可鉴别,故D正确.
故选D.
点评:本题考查利用滴加顺序不同鉴别物质,题目难度中等,注意滴加顺序不同实质是反应物量的不同,掌握常见与量及顺序有关的反应,注意基础知识的全面掌握,本题难度中等.

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)?3C(g)+D(g)达到平衡时,C的浓度为1.2mol/L,C的体积分数为a%.维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是( )
| A、6mol C+2mol D |
| B、1mol A+0.5mol B+1.5mol C+0.5mol D |
| C、1mol A+0.5mol B+1.5mol C |
| D、4mol A+2mol B |
某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
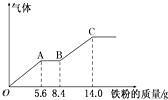 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A、原混合酸中HNO3的物质的量为0.1 mol |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、H2SO4浓度为2.5 mol?L-1 |
 某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下:
某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响.部分实验用表如下: 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.

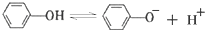 ,苯酚的酸性大于
,苯酚的酸性大于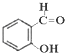 (邻羟基苯甲醛),其原因是
(邻羟基苯甲醛),其原因是 1000℃时,硫酸钠可与氢气发生反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).请回答下列问题:
1000℃时,硫酸钠可与氢气发生反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).请回答下列问题: