题目内容
11.碳酸有两个电离常数Ki1、Ki2,分别对应碳酸的两步电离.关于Ki1和Ki2说法正确的是( )| A. | Ki1的表达式为Ki1=$\frac{c({H}_{2}C{O}_{3})}{C({H}^{+})•C(HC{{O}_{3}}^{-})}$ | |
| B. | Ki2对应的电离过程是HCO3-+H2O≒H2CO3+OH- | |
| C. | 当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 | |
| D. | 改变条件使Ki1减小,则Ki2一定也减小 |
分析 A、Ki1的表达式为Ki1=$\frac{c({H}^{+})c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$;
B、Ki2对应的电离过程是HCO3-+H2O≒CO32-+H3O+;
C、Ki1与Ki2是温度的函数;
D、电离过程是吸热过程,要使Ki1减小,只能是降温,所以Ki2一定减小;
解答 解:A、Ki1的表达式为Ki1=$\frac{c({H}^{+})c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$,故A错误;
B、Ki2对应的电离过程是HCO3-+H2O≒CO32-+H3O+,而HCO3-+H2O≒H2CO3+OH-,是碳酸氢根离子的水解反应方程式,故B错误;
C、Ki1与Ki2是温度的函数,与反应进行的方向无关,故C错误;
D、电离过程是吸热过程,要使Ki1减小,只能是降温,所以Ki2一定减小,故D正确;
故选D.
点评 本题考查了弱电解质的电离,学生要清楚电离子常数表达式的书写、影响因素是解本题关键,难度中等.

练习册系列答案
相关题目
1.一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?xC(g),B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2.
下列有关说法正确的是( )
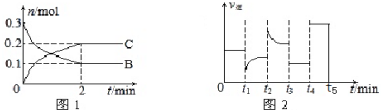
下列有关说法正确的是( )

| A. | x=2.反应开始2min内,v(A)=0.05 mol•L-1•min-1 | |
| B. | 若tl时改变的条件是降温,平衡正向移动,则该反应为放热反应 | |
| C. | 若t2时改变的条件是增大c的浓度,则t2时正反应速率减小 | |
| D. | t3-t5时间段B的浓度一定未发生变化 |
2.常温下,x mol•L-1的某一元酸溶液的pH=2,则下列关于x的取值正确的是( )
| A. | 一定等于0.01 | B. | 一定大于0.01 | ||
| C. | 一定大于或等于0.01 | D. | 可能小于0.01 |
6.在20℃时,某气态烃与氧气混合装入密闭容器中,点燃爆炸后,又恢复到20℃.此时容器内气体的压强为反应前的一半,经NaOH溶液吸收后,容器内几乎真空.此烃的化学式可能是( )
| A. | CH4 | B. | C3H4 | C. | C2H4 | D. | C4H8 |
16.分类方法在化学教材必修I中出现,下列分类标准合理的是( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据化学反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③CO、NO、N2O、NO2、N2O4、ClO2等形不成同价态的盐,故他们不是酸性氧化物
④根据反应中的热效应将化学反应分为放热反应和吸热反应.
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据化学反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③CO、NO、N2O、NO2、N2O4、ClO2等形不成同价态的盐,故他们不是酸性氧化物
④根据反应中的热效应将化学反应分为放热反应和吸热反应.
| A. | ①②③ | B. | ①③④ | C. | ①②④ | D. | ②③④ |
20.有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )
| A. |  1 mol甲分子内含有10 mol共价键 | |
| B. |  由乙分子构成的物质不能发生氧化反应 | |
| C. |  丙分子的二氯取代产物只有三种 | |
| D. |  分子丁显然是不可能合成的 |
1.在一密闭容器中进行下列反应:2SO2(g)+O2(g)?2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,可能存在的数据是( )
| A. | SO2为0.4mol/L,O2为0.2mol/L | B. | SO2为0.15mol/L | ||
| C. | SO2,SO3均为0.25mol/L | D. | SO3为0.4mol/L |
 理论上讲,任何自发的氧化还原反应都可以设计成原电池.
理论上讲,任何自发的氧化还原反应都可以设计成原电池.