题目内容
16.物质的类别和核心元素的化合价是研究物质性质的两个基本视角.
(1)图中X的电子式为
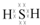 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.(2)Na2S2O3是一种用途广泛的钠盐.
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是b d
a.Na2S+S b.Z+S c.Na2SO3+Y d.NaHS+NaHSO3
②已知反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O.研究其反应速率时,下列说法正确的是b(填写字母序号).
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体.
①已知:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-296kJ•mol-1
则治理烟道气反应的热化学方程式为2CO(g)+SO2 (g)═S(s)+2CO2(g)△H=-270 kJ•mol-1.
②一定条件下,将CO与SO2以体积比为4:1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是c d(填写字母序号).
a.v (CO):v(SO2)=2:1 b.平衡常数不变
c.气体密度不变 d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为$\frac{7}{11}$.则SO2的转化率为60%.
分析 (1)X为H2S,S最外层6个电子,能够与2个H原子形成共价键;H2S在空气中变浑浊是因为被氧气氧化为S;同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强;
(2)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
②硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,反应速率越快,出现浑浊时间越短;
(3)①利用已知热化学方程式,利用盖斯定律进行书写;
②反应达到平衡状态时正逆反应速率相等,各组分浓度保持不变,据此分析;利用三段式法计算二氧化硫的转化率.
解答 解:(1)X为H2S,S最外层6个电子,能够与2个H原子形成共价键,其电子式为: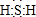 ;H2S在空气中变浑浊是因为被氧气氧化为S,所以S非金属性比O弱;同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强,
;H2S在空气中变浑浊是因为被氧气氧化为S,所以S非金属性比O弱;同主族元素最外层电子数相同,原子半径自上而下逐渐增大,得电子能力逐渐减弱,失电子能力逐渐增强,
故答案为: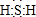 ;弱;电子层数增多,原子半径增大;
;弱;电子层数增多,原子半径增大;
(2)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c中S的化合价都大于2,bd符合题意,
故答案为:bd;
②根据硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,可以判断反应速率快慢,反应速率越快,出现浑浊时间越短,故答案为:b;
(3)①已知:①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1
②S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1
据盖斯定律①×2-②得:2CO(g)+SO2 (g)═S(s)+2CO2(g)△H=-270 kJ•mol-1,
故答案为:2CO(g)+SO2 (g)═S(s)+2CO2(g)△H=-270 kJ•mol-1;
②a、CO和SO2的速率之比始终等于化学计量数之比,其无法判断反应是否达到平衡状态,故a错误;
b、温度不变平衡常数始终不变,平衡常数不变不能说明反应达到平衡状态,故b错误;
c、容器体积不变,S为固态,反应正向进行气体体积减小,当气体质量不变时,说明各组分浓度不变,反应达到平衡状态,故c正确;
d、CO2和SO2的体积比保持不变说明正逆反应速率相等,反应达到平衡状态,故d正确;
由 2CO(g)+SO2 (g)═S(s)+2CO2(g)
反应前(mol) 4 1 0 0
转化了(mol)2x x x 2x
平衡后(mol)4-2x 1-x x 2x
混合气体中CO的体积分数为$\frac{7}{11}$,则有$\frac{4-2x}{4-2x+1-x+2x}$=$\frac{7}{11}$,x=0.6,
所以SO2的转化率为$\frac{0.6}{1}$×100%=60%,
故答案为:cd;60%.
点评 本题考查了核外电子的排布与电子式、氧化还原反应、盖斯定律的应用、化学平衡状态的判断、转化率计算,题目难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | 还原性 | B. | 氧化性 | C. | 酸性 | D. | 漂白性 |
| A. | 质子数c>b | B. | 离子的还原性Z->Y2- | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径X>W |
| A. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O═H3O++B2- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-═4OH- | |
| D. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| A. | 元素的电负性:Na>P>Cl | |
| B. | 某元素(R)气态基态原子的逐级电离能分别为738、1451、7733、10540、13630,当它与氯气反应时可能生成的阳离子是R2+ | |
| C. | 具有下列电子排布式的原子中,①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是④ | |
| D. | ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性就越强 |
| A. | 液态氯化钠、液态氯化氢 | B. | 熔融NaOH、熔融BaSO4 | ||
| C. | 石墨、分析纯盐酸 | D. | 冰醋酸、分析纯硫酸 |
| A. | 碳酸钠 | B. | 硫酸 | C. | 硫酸铜 | D. | 硝酸银 |
| A. | “天宫一号”中使用的碳纤维,是一种符合材料 | |
| B. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硅胶 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 | |
| D. | 光导纤维是传统无机非金属材料 |