题目内容
8.向某一无色溶液中滴入氯化钡溶液后,生成不溶于稀硝酸的白色沉淀,则该溶液中不可能含的物质是( )| A. | 碳酸钠 | B. | 硫酸 | C. | 硫酸铜 | D. | 硝酸银 |
分析 依据复分解反应的发生条件对选项物质与硫酸、硝酸银溶液反应进行判断,“银离子和氯离子结合生成的氯化银、硫酸根离子和钡离子结合生成的硫酸钡都是不溶于稀硝酸的白色沉淀”,碳酸钡易溶于稀硝酸.
解答 解:A.碳酸钠和氯化钡反应:Na2CO3+BaCl2=BaCO3↓+2NaCl,碳酸钡易溶于稀硝酸,BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O,则该溶液中不可能含有碳酸钠,故A选;
B.氯化钡和稀硫酸反应H2SO4+BaCl2=BaSO4↓+2HCl;产生硫酸钡沉淀,为不溶于稀硝酸的白色沉淀,故B不选;
C.氯化钡和稀硫酸反应CuSO4+BaCl2=BaSO4↓+CuCl2;产生硫酸钡沉淀,为不溶于稀硝酸的白色沉淀,故C不选;
D.氯化钡和硝酸银反应:2AgNO3+BaCl2=AgCl↓+Ba(NO3)2,产生氯化银白色沉淀,为不溶于稀硝酸的白色沉淀,故D不选;
故选A.
点评 本题主要考查了如何判断物质混合时的实验现象方面的问题,掌握常见酸碱盐的溶解性以及复分解反应发生的条件是解题的关键,另外注意两种特殊的沉淀,硫酸钡和氯化银既不溶于水,也不溶于酸,注意检验硫酸根的方法是:先向其中加入盐酸酸化,若无白色沉淀生成,再加氯化钡溶液,若有白色沉淀生成,则证明有硫酸根离子,检验氯离子的方法是:向其中加入硝酸酸化的硝酸银溶液,若有白色沉淀生成,则证明有氯离子,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.下列四组实验,根据实验事实得出的结论,正确的是( )
| A. | 在某未知试液中加入浓的NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体--原未知试液中一定含有NH4+ | |
| B. | 在某未知试液中加入硝酸银溶液,产生白色沉淀--原未知试液中一定含有Cl- | |
| C. | 用洁净的铂丝蘸取某溶液,置于火焰上灼烧,观察到火焰呈黄色--原溶液中一定含有Na+,不含有K+ | |
| D. | 在某未知试液中滴加过量的稀盐酸得到澄清溶液,再往澄清溶液中加入BaCl2溶液得白色沉淀--原未知试液中一定含有SO42- |
19.推理是一种重要的学习和研究方法.下列推理正确的是( )
| A. | 单质中只含一种元素,所以只含一种元素的物质一定是单质 | |
| B. | 化学变化前后物质的质量总和不变,所以1g H2和1g O2一定能够生成2g H2O | |
| C. | 碱性溶液能使酚酞溶液变红,所以能使酚酞溶液变红的物质一定呈碱性 | |
| D. | 中和反应有盐和水生成,所以有盐和水生的反应一定是中和反应 |
3.3molH2和3molHe相同的是( )
| A. | 原子数 | B. | 相对分子质量 | C. | 质量 | D. | 质子数 |
13.能够一次性操作就能鉴别Na2SO3、BaCl2、NaCl、Na2CO3四种物质的一种试剂是( )
| A. | AgNO3 | B. | 稀H2SO4 | C. | 稀HCl | D. | 稀HNO3 |
20.下列无色溶液中,离子可大量共存的是( )
| A. | Cu2+、K+、OH-、CO32- | B. | H+、Ba2+、SO32-、Br - | ||
| C. | K+、Na+、Cl-、MnO4- | D. | Ca2+、Na+、HCO3-、I- |
17.如表是反应的离子方程式,其中评价关系不正确的是( )
| 选项 | 反应 | 离子方程式 | 评价 |
| A | 亚硫酸钡与盐酸反应 | BaSO3+2H+═Ba2++SO2↑+H2O | 正确 |
| B B | 向NaHSO4溶液中逐滴加入Ba(OH)2至溶液呈中性 | H++SO42-+Ba2++OH-═BaSO4+H2O | 正确 |
| C C | 铝制易拉罐去膜后放入NaOH溶液中 | 2Al+2OH-═2AlO2-+H2↑ | 错误,方程式未配平 |
| D | 少量铁粉与稀硝酸反应 | 3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | 错误,少量铁粉与稀硝酸反应应生成Fe3+ |
| A. | A | B. | B | C. | C | D. | D |

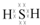 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.