题目内容
4.下列离子方程式中,书写正确的是( )| A. | 弱酸酸式盐NaHB在水溶液中水解:HB-+H2O═H3O++B2- | |
| B. | 电解饱和食盐水:C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+OH- | |
| C. | 氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-═4OH- | |
| D. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
分析 A.该反应为电离方程式,且应该使用可逆号;
B.离子方程式两边负电荷不相等,违反了电荷守恒;
C.氢氧燃料电池在碱性介质中的正极氧气得到电子生成氢氧根离子;
D.漏掉了生成氢氧化镁沉淀的反应.
解答 解:A.弱酸酸式盐NaHB在水溶液中水解生成H2B和氢氧根离子,正确的水解方程式为:HB-+H2O?OH-+H2B,故A错误;
B.电解饱和食盐水生成氢氧化钠、氯气和氢气,正确的离子方程式为:2C1-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,故B错误;
C.氢氧燃料电池在碱性介质中的正极反应式为:O2+2H2O+4e-═4OH-,故C正确;
D.硫酸镁与氢氧化钡溶液反应生成氢氧化镁沉淀和硫酸钡,正确的离子方程式为:SO42-+Ba2++Mg2++2OH-=Mg(OH)2↓+BaSO4↓,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
12. (1)用轨道示意图表示Fe3+的价电子排布
(1)用轨道示意图表示Fe3+的价电子排布 .
.
(2)某主族元素的电离能(电子伏特)如下:
,判断该元素处于VA族;
(3)若ABn的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的是C(填字母).
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确
(4)臭氧分子的结构如图1,呈V型,键角116.5°.请回答:
①臭氧与氧气的关系是同素异形体.
②下列分子与臭氧分子的结构最相似的是C(填字母).
A.H2O B.CO2 C.SO2 D.BeCl2
③臭氧分子是否为极性分子是(填“是”或“否”).
(5)在短周期元素中,由三种元素组成的既有离子键又有共价键和配位键,且阴、阳离子所含电子数相差8个,该物质的电子式 .
.
(6)金属钛为六方最密堆积结构,测得钛的原子半径为r,晶胞结构如图2所示,求该晶胞的边长a=2r,b=$\frac{4\sqrt{6}}{3}$r(用含r的代数式表示)
 (1)用轨道示意图表示Fe3+的价电子排布
(1)用轨道示意图表示Fe3+的价电子排布 .
.(2)某主族元素的电离能(电子伏特)如下:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
(3)若ABn的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的是C(填字母).
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确
(4)臭氧分子的结构如图1,呈V型,键角116.5°.请回答:
①臭氧与氧气的关系是同素异形体.
②下列分子与臭氧分子的结构最相似的是C(填字母).
A.H2O B.CO2 C.SO2 D.BeCl2
③臭氧分子是否为极性分子是(填“是”或“否”).
(5)在短周期元素中,由三种元素组成的既有离子键又有共价键和配位键,且阴、阳离子所含电子数相差8个,该物质的电子式
 .
.(6)金属钛为六方最密堆积结构,测得钛的原子半径为r,晶胞结构如图2所示,求该晶胞的边长a=2r,b=$\frac{4\sqrt{6}}{3}$r(用含r的代数式表示)
19.推理是一种重要的学习和研究方法.下列推理正确的是( )
| A. | 单质中只含一种元素,所以只含一种元素的物质一定是单质 | |
| B. | 化学变化前后物质的质量总和不变,所以1g H2和1g O2一定能够生成2g H2O | |
| C. | 碱性溶液能使酚酞溶液变红,所以能使酚酞溶液变红的物质一定呈碱性 | |
| D. | 中和反应有盐和水生成,所以有盐和水生的反应一定是中和反应 |
9.25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.下列有关离子浓度关系叙述正确的是( )

| A. | pH=5.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 向W点所表示的1.0L溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) | |
| D. | pH=3.5溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol•L-1 |
13.能够一次性操作就能鉴别Na2SO3、BaCl2、NaCl、Na2CO3四种物质的一种试剂是( )
| A. | AgNO3 | B. | 稀H2SO4 | C. | 稀HCl | D. | 稀HNO3 |
14.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1mol铁粉,充分搅拌后铁完全反应,同时析出0.1mol Ag.则下列结论中不正确的是( )
| A. | 向反应后的溶液中继续加入少量铁粉,铁粉可以继续溶解 | |
| B. | 氧化性:Ag+>Fe3+>Cu2+>Zn2+ | |
| C. | 反应后溶液的质量减轻 | |
| D. | 反应后溶液中Cu2+与Fe2+的物质的量之比为1:1 |
 )可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式:
)可导致患者出现头痛、恶心等症状,需静脉注射小苏打(NaHCO3)溶液,利用小苏打与水杨酸分子中的羧基反应生成水杨酸钠,使症状缓解.写出水杨酸与小苏打反应的化学方程式: .
. 在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目
在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目
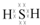 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O弱(填“强”或“弱”).用原子结构解释原因:同主族元素最外层电子数相同,从上到下,电子层数增多原子半径增大,得电子能力逐渐减弱.