��Ŀ����
 �о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ�Ŀ��⣮
�о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ���õ�˫Ӯ�Ŀ��⣮��1��CO�����ںϳɼ״�����ѹǿΪ0.1Mpa�����£������ΪbL���ܱ������г���amolCO��2amolH2���ڴ��������ºϳɼ״���
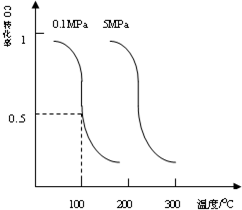
CO��g��+2H2��g��?CH3OH��g��ƽ��ʱCO��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��
��i���÷�Ӧ����
��ii��100��ʱ���÷�Ӧ��ƽ�ⳣ����K=
a���÷�Ӧʹ�ô������岻��
b���÷�Ӧ�������ںܶ�ʱ������ɣ�
c���÷�Ӧ�ﵽƽ��ʱ������һ�ַ�Ӧ��ٷֺ�����С��
d���÷�Ӧһ���Ƿ��ȷ�Ӧ��
��iii�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���amolCO��2amolH2���ﵽƽ��ʱCOת����
��iv����ij�¶��£���һ�ݻ�������ܱ������г���2.5molCO��7.5molH2����Ӧ����CH3OH��g�����ﵽƽ��ʱ��COת����Ϊ90%����ʱ������ѹǿΪ��ʼʱ��ѹǿ
��2��ij�¶������£�����CO2��g����H2��g���������1��4��ϣ����ʵ�ѹǿ�ʹ��������¿��Ƶü��飬��֪��
CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890.3KJ/mol
H2��g��+
| 1 |
| 2 |
��CO2��g����H2��g����Ӧ����Һ̬ˮ���Ȼ�ѧ����ʽΪ��
��5��25��Cʱ����a mol?L-1�İ�ˮ��0.1mol?L-1������������ϣ�
�ٵ���Һ������Ũ�ȹ�ϵ����c��NH4+����c��Cl-��ʱ����Ӧ���������Ϊ
a������㣬��ˮʣ�� b����ˮ������ǡ����ȫ��Ӧ c���������
�ڵ���Һ��c��NH4+��=c��Cl-��ʱ���ú�a�Ĵ���ʽ��ʾNH3?H2O�ĵ��볣��Kb=
���㣺ת�������¶ȡ�ѹǿ�ı仯����,�Ȼ�ѧ����ʽ,��ѧƽ���Ӱ������,���������ˮ��Һ�еĵ���ƽ��
ר�⣺���ʵ����ר��
��������1����i����ͼ��֪��ѹǿһ��ʱ�����¶����ߣ�CO��ת���ʽ��ͣ��������¶�ƽ�����淴Ӧ�ƶ����ݴ��жϣ�
��ii����ѧƽ�ⳣ��K=
������CO��ת���ʣ���������ʽ�����ƽ��ʱ����ֵ����ʵ������������ƽ��ʱ����ֵ�Ũ�ȣ�����ƽ�ⳣ�����㣻
���淴Ӧ��ƽ�ⳣ��Խ��˵����Ӧ���еij̶�Խ����˵����Ӧ���ʿ���������˵���÷�Ӧ��ͨ��������һ�����Է���������˵����Ӧ�����Ȼ��Ƿ��ȣ�
��iii�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���a mol CO��g����2a mol H2��g������ЧΪ��ԭƽ��Ļ���������һ��ѹǿ��ƽ��������Ӧ�ƶ���
��ѧƽ�ⳣ��ֻ���¶�Ӱ�죬��Ũ���أ��¶Ȳ��䣬ƽ�ⳣ�����䣻
��iv������μӷ�Ӧ��CO�����ʵ��������ò���������ƽ��ʱ��Ӧ���������ʵ����仯������������ƽ��ʱ�ܵ����ʵ��������ú��º����£�ѹǿ֮�ȵ������ʵ���֮�Ƚ��
��2�����ݸ�˹������дĿ���Ȼ�ѧ����ʽ��
��3���ٸ��ݵ���غ��֪��c��NH4+��+c��H+��=c��Cl-��+c��OH-��������c��NH4+����c��Cl-������c��H+����c��OH-������Һ�����ԣ��ݴ˽��ѡ���жϣ�
����Һ�д���ƽ��NH3��H2O?NH4++OH-�����ݵ���غ������Һ��pHֵ������������Һ��c��OH-��������������Ũ�ȼ���c��NH4+�������������غ������Һ��c��NH3��H2O��������NH3?H2O�ĵ��볣������ʽ���㣮
��ii����ѧƽ�ⳣ��K=
| c(CH3OH) |
| c(CO)��c2(H2) |
���淴Ӧ��ƽ�ⳣ��Խ��˵����Ӧ���еij̶�Խ����˵����Ӧ���ʿ���������˵���÷�Ӧ��ͨ��������һ�����Է���������˵����Ӧ�����Ȼ��Ƿ��ȣ�
��iii�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���a mol CO��g����2a mol H2��g������ЧΪ��ԭƽ��Ļ���������һ��ѹǿ��ƽ��������Ӧ�ƶ���
��ѧƽ�ⳣ��ֻ���¶�Ӱ�죬��Ũ���أ��¶Ȳ��䣬ƽ�ⳣ�����䣻
��iv������μӷ�Ӧ��CO�����ʵ��������ò���������ƽ��ʱ��Ӧ���������ʵ����仯������������ƽ��ʱ�ܵ����ʵ��������ú��º����£�ѹǿ֮�ȵ������ʵ���֮�Ƚ��
��2�����ݸ�˹������дĿ���Ȼ�ѧ����ʽ��
��3���ٸ��ݵ���غ��֪��c��NH4+��+c��H+��=c��Cl-��+c��OH-��������c��NH4+����c��Cl-������c��H+����c��OH-������Һ�����ԣ��ݴ˽��ѡ���жϣ�
����Һ�д���ƽ��NH3��H2O?NH4++OH-�����ݵ���غ������Һ��pHֵ������������Һ��c��OH-��������������Ũ�ȼ���c��NH4+�������������غ������Һ��c��NH3��H2O��������NH3?H2O�ĵ��볣������ʽ���㣮
���
�⣺��1����i����ͼ��֪��ѹǿһ��ʱ�����¶����ߣ�CO��ת���ʽ��ͣ��������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��2��100�棬ƽ��ʱCO��ת����Ϊ0.5�����Բμӷ�Ӧ��CO�����ʵ���Ϊ0.5amol��
CO��g��+2H2��g�� CH3OH��g����
CH3OH��g����
��ʼ��mol����a 2a 0
�仯��mol����0.5a a 0.5a
ƽ�⣨mol����0.5a a 0.5a
����ƽ��ʱ��CO��Ũ��Ϊ
=
mol/L��H2��Ũ��Ϊ
=
mol/L��CH3OH��Ũ��Ϊ
=
mol/L��100��ʱ�÷�Ӧ��ƽ�ⳣ��k�T
=
��
a�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���÷�Ӧ��ͨ��������һ�����Է������÷�Ӧ������Ҫ�����ſ��Խ��У���a����
b�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���������·�Ӧ���ʺܿ죬��b����
c�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ�Ӧ��ƽ��ʱ������һ�ַ�Ӧ��İٷֺ�����С����c��ȷ��
d�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���÷�Ӧ�����Ȼ��Ƿ��ȣ���d����
�ʴ�Ϊ��
��c��
��iii�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���a mol CO��g����2a mol H2��g������ЧΪ��ԭƽ��Ļ���������һ��ѹǿ��ƽ��������Ӧ�ƶ���CO��ת��������ѧƽ�ⳣ��ֻ���¶�Ӱ�죬��Ũ���أ��¶Ȳ��䣬ƽ�ⳣ�����䣬
�ʴ�Ϊ�������䣻
��iv���μӷ�Ӧ��CO�����ʵ���Ϊ2.5mol��90%=2.25mol����
CO��g��+2H2��g��?CH3OH��g�� ���ʵ������١�n
1 2
2.25mol 4.5mol
��ƽ��ʱ�ܵ����ʵ���Ϊ2.5mol+7.5mol-4.5mol=5.5mol�����º�����ѹǿ֮�ȵ������ʵ���֮�ȣ���ƽ��ʱ������ѹǿΪ��ʼʱѹǿ��
=0.55����
�ʴ�Ϊ��0.55��
��2����֪����CH4��g��+2O2��g���TCO2��g��+2H2O��l����H1=-890.3kJ?mol-1
��H2��g��+
O2��g���TH2O��l����H2=-285.8kJ?mol-1��
���ø�˹���ɣ����ڡ�4-�ٿɵã�CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=4����-285.8kJ?mol-1��-��-890.3kJ?mol-1��=-252.9kJ?mol-1��
�ʴ�Ϊ��CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=-252.9kJ?mol-1��
��5���ٸ��ݵ���غ��֪��c��NH4+��+c��H+��=c��Cl-��+c��OH-��������c��NH4+����c��Cl-������c��H+����c��OH-������Һ�����ԣ�
a������㣬��ˮʣ�࣬Ϊ�Ȼ���백ˮ�Ļ����Һ��笠�����ˮ��̶ȴ��ڰ�ˮ�ĵ���ʱ����Һ���ܳ����ԣ���a���ܣ�
b����ˮ������ǡ����ȫ��Ӧ��Ϊ�Ȼ����Һ��笠�����ˮ�⣬��Һ�����ԣ���b���ܣ�
c�������������ҺΪ�Ȼ�李�����Ļ����Һ����Һ�����ԣ���c���ܣ�
��ѡ��abc��
�ڸ��ݵ���غ���c��NH4+��+c��H+��=c��Cl-��+c��OH-��������c��NH4+��=c��Cl-������c��H+��=c��OH-������Һ�����ԣ�����Һ��c��OH-��=10-7mol/L����Һ��c��NH4+��=c��Cl-��=
��0.1mol?L-1=0.05mol?L-1���ʻ�Ϻ���Һ��c��NH3��H2O��=
��amol?L-1-0.05mol?L-1=��0.5a-0.05��mol/L��NH3?H2O�ĵ��볣��Kb=
=
��
�ʴ�Ϊ��
��
�ʴ�Ϊ�����ȣ�
��2��100�棬ƽ��ʱCO��ת����Ϊ0.5�����Բμӷ�Ӧ��CO�����ʵ���Ϊ0.5amol��
CO��g��+2H2��g��
 CH3OH��g����
CH3OH��g������ʼ��mol����a 2a 0
�仯��mol����0.5a a 0.5a
ƽ�⣨mol����0.5a a 0.5a
����ƽ��ʱ��CO��Ũ��Ϊ
| 0.5a mol |
| v L |
| a |
| 2v |
| a mol |
| v L |
| a |
| v |
| 0.5a mol |
| v L |
| a |
| 2v |
| ||||
|
| v2 |
| a2 |
a�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���÷�Ӧ��ͨ��������һ�����Է������÷�Ӧ������Ҫ�����ſ��Խ��У���a����
b�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���������·�Ӧ���ʺܿ죬��b����
c�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ�Ӧ��ƽ��ʱ������һ�ַ�Ӧ��İٷֺ�����С����c��ȷ��
d�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���÷�Ӧ�����Ȼ��Ƿ��ȣ���d����
�ʴ�Ϊ��
| v2 |
| a2 |
��iii�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���a mol CO��g����2a mol H2��g������ЧΪ��ԭƽ��Ļ���������һ��ѹǿ��ƽ��������Ӧ�ƶ���CO��ת��������ѧƽ�ⳣ��ֻ���¶�Ӱ�죬��Ũ���أ��¶Ȳ��䣬ƽ�ⳣ�����䣬
�ʴ�Ϊ�������䣻
��iv���μӷ�Ӧ��CO�����ʵ���Ϊ2.5mol��90%=2.25mol����
CO��g��+2H2��g��?CH3OH��g�� ���ʵ������١�n
1 2
2.25mol 4.5mol
��ƽ��ʱ�ܵ����ʵ���Ϊ2.5mol+7.5mol-4.5mol=5.5mol�����º�����ѹǿ֮�ȵ������ʵ���֮�ȣ���ƽ��ʱ������ѹǿΪ��ʼʱѹǿ��
| 5.5mol |
| 2.5mol+7.5mol |
�ʴ�Ϊ��0.55��
��2����֪����CH4��g��+2O2��g���TCO2��g��+2H2O��l����H1=-890.3kJ?mol-1
��H2��g��+
| 1 |
| 2 |
���ø�˹���ɣ����ڡ�4-�ٿɵã�CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=4����-285.8kJ?mol-1��-��-890.3kJ?mol-1��=-252.9kJ?mol-1��
�ʴ�Ϊ��CO2��g��+4H2��g��=CH4��g��+2H2O��l����H=-252.9kJ?mol-1��
��5���ٸ��ݵ���غ��֪��c��NH4+��+c��H+��=c��Cl-��+c��OH-��������c��NH4+����c��Cl-������c��H+����c��OH-������Һ�����ԣ�
a������㣬��ˮʣ�࣬Ϊ�Ȼ���백ˮ�Ļ����Һ��笠�����ˮ��̶ȴ��ڰ�ˮ�ĵ���ʱ����Һ���ܳ����ԣ���a���ܣ�
b����ˮ������ǡ����ȫ��Ӧ��Ϊ�Ȼ����Һ��笠�����ˮ�⣬��Һ�����ԣ���b���ܣ�
c�������������ҺΪ�Ȼ�李�����Ļ����Һ����Һ�����ԣ���c���ܣ�
��ѡ��abc��
�ڸ��ݵ���غ���c��NH4+��+c��H+��=c��Cl-��+c��OH-��������c��NH4+��=c��Cl-������c��H+��=c��OH-������Һ�����ԣ�����Һ��c��OH-��=10-7mol/L����Һ��c��NH4+��=c��Cl-��=
| 1 |
| 2 |
| 1 |
| 2 |
| 10-7��0.05 |
| 0.5a-0.05 |
| 10-8 |
| a-0.1 |
�ʴ�Ϊ��
| 10-8 |
| a-0.1 |
���������⿼�黯ѧƽ��ͼ��ѧƽ���йؼ��㡢��ѧƽ�ⳣ����Ӱ�컯ѧƽ������ء��Ȼ�ѧ����ʽ��д����Һ������жϡ�����ƽ�ⳣ������ȣ��Ƕ�֪ʶ���ۺ����ã���5����ע������Ũ�ȵļ��㣬Ӧ��ǿƽʱ֪ʶ�Ļ��ۣ��Ѷ��еȣ�

��ϰ��ϵ�д�
 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
�����Ŀ
�ڸ����������µ�������Һ�У�һ���ܴ���������������ǣ�������
| A��pH=3����Һ��Ca2+��CH3COOH��Br-��Na+ |
| B��ˮ�����c��H+��=1��10-13mo1?L-1����Һ��Na+��K+��SO42-��CO32- |
| C�����д���Fe3+����Һ��Na+��Mg2+��NO3-��SCN- |
| D�����д���NO3-����Һ��NH4+��H+��SO42-��I- |
���Ӽ���ij������ַ������������Ӽ���ķ����в��������ǣ�������
| ���鷽�� | ������ | ��ɫ�� | ���巨 |
| �ж����� | ��Ӧ���г������ɻ��ܽ� | ��Ӧ������ɫ�仯 | ��Ӧ������������ |
| A��CO32----------------���巨 |
| B��SO42------------------������ |
| C��H+--------------------��ɫ�� |
| D��Cl---------------------���巨 |
ij�о���ѧϰС��������������װ�õ��й��÷������в��������ǣ�������
A�� ��װ�ã�������֤��̼�ķǽ����Աȹ�ǿ |
B�� ��װ�ã���Ƥ�ܵ�������ƽ��ѹǿ��ʹˮ˳������ |
C�� ��װ�ã���ͼʾ�ķ����ܼ���װ�õ������� |
D��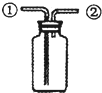 ��װ�ã����ռ�������̼���� |
ʵ���ҴӺ�������ȡ�������»�ѧ��Ӧ��2NaI+Cl2=2NaCl+I2��һ��Ӧ�������ͣ�������
| A�����Ϸ�Ӧ | B���ֽⷴӦ |
| C���û���Ӧ | D�����ֽⷴӦ |
��ʯ��ʯ��ˮ������Ϊԭ�����ռ�������ķ�Ӧ���Ͳ�������������
| A���ֽⷴӦ | B���û���Ӧ |
| C�����Ϸ�Ӧ | D�����ֽⷴӦ |

 SO2��NOx�ڻ�ѧ��ҵ������Ҫ��;��Ҳ�Ǵ�����Ⱦ����Ҫ��Դ�����������ò��أ�Ԥ�������������ǵ�ǰ��ҵ�Ϻͻ������������о�����Ҫ����֮һ��
SO2��NOx�ڻ�ѧ��ҵ������Ҫ��;��Ҳ�Ǵ�����Ⱦ����Ҫ��Դ�����������ò��أ�Ԥ�������������ǵ�ǰ��ҵ�Ϻͻ������������о�����Ҫ����֮һ��