题目内容
制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离.下面是某化学兴趣小组的活动记录:
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
实验方案:
Ⅰ、溶解:称取29.8gKCl和40.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解.
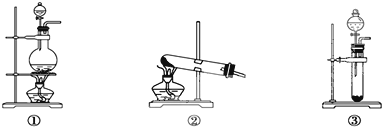
Ⅱ、蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩.在100°C时蒸发掉50.0g水,维持该温度,在保温漏斗(如图1所示)中趁热过滤析出的晶体.得晶体m1g.
Ⅲ、冷却结晶:待滤液冷却至室温(实验时室温为10°C)后,进行减压过滤.得KNO3粗产品m2g.
IV、重结晶:在100°C时将粗产品全部溶于适量水,制成饱和溶液,冷却至室温后抽滤.得KNO3纯品m3g.
假定:①盐类共存时不影响各自的溶解度;②各种过滤操作过程中,溶剂的损耗忽略不计.试回答有关问题:

(1)操作Ⅱ中趁热过滤的目的是 ,
(2)操作Ⅱ中承接滤液的烧杯中需要先加入少量蒸馏水,目的是 ,
(3)操作Ⅲ中采用减压过滤,其优点是 .该小组同学所用的装置如图2所示,仪器A和B的名称分别是 ,该装置有三处错误,分别是 ,若实验过程中发现倒吸现象,应采取的措施是 .
(4)KNO3晶体纯品的产率 .
查阅资料:文献中查得,四种盐在不同温度下的溶解度(S/g)如下表:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10°C | 80.5 | 20.9 | 35.7 | 31.0 |
| 100°C | 175 | 246 | 39.1 | 56.6 |
Ⅰ、溶解:称取29.8gKCl和40.0gNaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解.
Ⅱ、蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩.在100°C时蒸发掉50.0g水,维持该温度,在保温漏斗(如图1所示)中趁热过滤析出的晶体.得晶体m1g.
Ⅲ、冷却结晶:待滤液冷却至室温(实验时室温为10°C)后,进行减压过滤.得KNO3粗产品m2g.
IV、重结晶:在100°C时将粗产品全部溶于适量水,制成饱和溶液,冷却至室温后抽滤.得KNO3纯品m3g.
假定:①盐类共存时不影响各自的溶解度;②各种过滤操作过程中,溶剂的损耗忽略不计.试回答有关问题:

(1)操作Ⅱ中趁热过滤的目的是
(2)操作Ⅱ中承接滤液的烧杯中需要先加入少量蒸馏水,目的是
(3)操作Ⅲ中采用减压过滤,其优点是
(4)KNO3晶体纯品的产率
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)根据不同温度硝酸钾的溶解度不同分析,温度较低时,硝酸钾因溶解度变小而析出.
(2)若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,可析出NaCl杂质;
(3)减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;根据图片判断所用仪器;若实验过程中发现倒吸现象,应采取的措施是打开旋塞K;
(4)先根据氯化钾和硝酸钠的质量计算其物质的量,把氯化钾和硝酸钠的混合溶液看成氯化钠和硝酸钾的混合溶液,求出理论产出硝酸钾的质量,根据100℃时,硝酸钾的溶解度判断是否析出硝酸钾及析出的固体质量;再根据10℃时硝酸钾的溶解度判断是否有固体析出及析出的固体质量,然后求KNO3晶体纯品的产率.
(2)若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,可析出NaCl杂质;
(3)减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;根据图片判断所用仪器;若实验过程中发现倒吸现象,应采取的措施是打开旋塞K;
(4)先根据氯化钾和硝酸钠的质量计算其物质的量,把氯化钾和硝酸钠的混合溶液看成氯化钠和硝酸钾的混合溶液,求出理论产出硝酸钾的质量,根据100℃时,硝酸钾的溶解度判断是否析出硝酸钾及析出的固体质量;再根据10℃时硝酸钾的溶解度判断是否有固体析出及析出的固体质量,然后求KNO3晶体纯品的产率.
解答:
解:(1)温度较低时,硝酸钾因溶解度变小而析出,为防止降温时析出硝酸钾而降低产率,所以要趁热过滤.
故答案为:防止降温时析出硝酸钾而降低产率;
(2)硝酸钾晶体的制备实验中,蒸发浓缩硝酸钠和氯化钾的混合溶液,氯化钠晶体析出后趁热过滤,承接滤液的烧杯应预先加蒸馏水,以防降温氯化钠溶液达饱和而析出,
故答案为:防止降温氯化钠溶液达饱和而析出;
(3)减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;
根据图片知,A为吸滤瓶,B为抽滤瓶;
布氏漏斗上的橡胶塞插入吸滤瓶内不能太长,为了防止液体沿着漏斗下端从支管口抽进去,需布氏漏斗的颈口斜面与吸滤瓶支管口相对,安全瓶内左侧导管不能太长,
若实验过程中发现倒吸现象,应采取的措施是打开旋塞K.
故答案为:加快过滤速度,并能得到较干燥的沉淀;吸滤瓶、抽滤瓶;布氏漏斗上的橡胶塞插入吸滤瓶内过长、布氏漏斗的颈口斜面未与吸滤瓶支管口相对、安全瓶内左侧导管太长;打开旋塞K;
(4)29.8g KCl的物质的量=
=0.4mol;34.0g NaNO3的物质的量=
=0.4mol,
氯化钾和硝酸钠不反应,所以氯化钾和硝酸钠的混合溶液可看作是氯化钠和硝酸钾的混合溶液,硝酸钾和氯化钠的物质的量还是0.4mol,硝酸钾的质量为40.4g,氯化钠的质量为23.4g.100℃时,20g水中溶有硝酸钾的质量为246g×
=49.2g>40.4g,所以硝酸钾形成的是不饱和溶液,10℃时,20g水中溶有硝酸钾的质量为20.9g×
=4.18g<40.4g,所以析出硝酸钾的质量为40.4g-4.18g=36.22g;所以KNO3晶体纯品的产率
×100%=89.65%,
故答案为:89.65%.
故答案为:防止降温时析出硝酸钾而降低产率;
(2)硝酸钾晶体的制备实验中,蒸发浓缩硝酸钠和氯化钾的混合溶液,氯化钠晶体析出后趁热过滤,承接滤液的烧杯应预先加蒸馏水,以防降温氯化钠溶液达饱和而析出,
故答案为:防止降温氯化钠溶液达饱和而析出;
(3)减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;
根据图片知,A为吸滤瓶,B为抽滤瓶;
布氏漏斗上的橡胶塞插入吸滤瓶内不能太长,为了防止液体沿着漏斗下端从支管口抽进去,需布氏漏斗的颈口斜面与吸滤瓶支管口相对,安全瓶内左侧导管不能太长,
若实验过程中发现倒吸现象,应采取的措施是打开旋塞K.
故答案为:加快过滤速度,并能得到较干燥的沉淀;吸滤瓶、抽滤瓶;布氏漏斗上的橡胶塞插入吸滤瓶内过长、布氏漏斗的颈口斜面未与吸滤瓶支管口相对、安全瓶内左侧导管太长;打开旋塞K;
(4)29.8g KCl的物质的量=
| 29.8g |
| 74.5g/mol |
| 34.0g |
| 85g/mol |
氯化钾和硝酸钠不反应,所以氯化钾和硝酸钠的混合溶液可看作是氯化钠和硝酸钾的混合溶液,硝酸钾和氯化钠的物质的量还是0.4mol,硝酸钾的质量为40.4g,氯化钠的质量为23.4g.100℃时,20g水中溶有硝酸钾的质量为246g×
| 1 |
| 5 |
| 1 |
| 5 |
| 36.22g |
| 40.4g |
故答案为:89.65%.
点评:本题考查了物质的分离和提纯等知识点,为高频考点,侧重于学生的分析、实验恶化计算能量的考查,题目综合性较强,掌握减压过滤操作、有关结晶的计算是解答本题的关键,本题难度较大.

练习册系列答案
相关题目
 膳食纤维具有的突出保健功能,近年来受到 人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有的突出保健功能,近年来受到 人们的普遍关注,被世界卫生组织称为人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构如图所示.下列有关芥子醇的说法正确的是( )| A、芥子醇的分子式是C11H12O4 |
| B、芥子醇分子中所有碳原子不可能在同一平面 |
| C、1mol芥子醇能与足量溴水反应消耗3molBr2 |
| D、1mol芥子醇与足量的氢气反应消耗氢气4mol |
1mol过氧化钠与2mol碳酸氢钾固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
| A、Na2CO3 |
| B、K2CO3、Na2CO3 |
| C、NaOH、K2CO3 |
| D、K2CO3、NaOH、Na2CO3 |
 实验室要用CuSO4?5H2O晶体配制500mL 0.1mol/L CuSO4溶液,回答下列问题:
实验室要用CuSO4?5H2O晶体配制500mL 0.1mol/L CuSO4溶液,回答下列问题: