题目内容
7.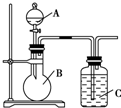 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.(1)已知硅酸(H2SiO3)是一种难溶于水的弱酸,呈白色.现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3.
A中装试剂硝酸,B中装试剂碳酸钙,C中装试剂硅酸钠溶液.
(2)写出C中反应的离子方程式CO2+SiO32-+H2O=H2SiO3↓+CO32-.
分析 由强酸能制弱酸的规律结合硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3;据此分析.
解答 解:(1)现有硝酸溶液、碳酸钙、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:酸性:HNO3>H2CO3>H2SiO3;因此先加入硝酸和碳酸钙反应生成二氧化碳,二氧化碳通入硅酸钠溶液生成硅酸沉淀;
故答案为:硝酸溶液;碳酸钙;硅酸钠溶液;
(2)装置C中二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:CO2+SiO32-+H2O=H2SiO3↓+CO32-;
故答案为:CO2+SiO32-+H2O=H2SiO3↓+CO32-.
点评 本题考查了酸性强弱的比较实验设计、试剂选择、离子方程式的书写,熟练掌握物质性质是解题关键,题目难度不大.

练习册系列答案
相关题目
17.已知25℃时,CaCO3饱和溶液中c(Ca2+)=5.3×10-5mol•L-1,MgCO3的饱和溶液中c(Mg2+)=2.6×10-3mol•L-1.若在5mL浓度均为0.01mol•L-1的CaCl2和MgCl2的混合溶液中加入5mL0.012mol•L-1的Na2CO3溶液,充分反应后过滤得到滤液M和沉淀N(不考虑溶液的体积变化),下列说法不正确的是( )
| A. | 25℃时,Ksp(CaCO3)=2.8×10-9 | |
| B. | 加入Na2CO3溶液的过程中,先生成CaCO3沉淀 | |
| C. | 滤液M中c(Cl-)>c(Na+)>c(Mg2+)>c(CO32-)>c(OH-) | |
| D. | 滤液M中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=$\frac{{K}_{sp}(CaC{O}_{3})}{{K}_{sp}(MgC{O}_{3})}$ |
18.下列电离方程式正确的是( )
| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | K2CO3?2K++CO32- | D. | CH3COONH4=NH4++CH3COO- |
2.酸根RO3-所含电子数比硝酸根离子(NO3-)的电子数多10,下列说法中正确的是( )
| A. | R是第三周期元素 | |
| B. | R元素的最高正价与N元素最高正价相同 | |
| C. | RO3-和NO3-均只能被还原,不能被氧化 | |
| D. | R和N两元素的单质都是空气的主要成分 |
12.四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法正确的是( )
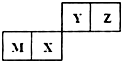

| A. | M与Z形成的化合物中只存在离子键 | |
| B. | X的最简单气态氢化物的热稳定性比Z的强 | |
| C. | 原子半径Z>Y | |
| D. | M的最高价氧化物对应水化物能与NaOH溶液反应 |
18.若t℃时,在体积为2升的密闭容器中发生反应:X(g)+3Y(g)?2Z(g)△H=-QkJ•mol-1 ((Q>0),各组分在不同时刻的浓度如下表,下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始物质的量/mol | 2 | 4 | 0 |
| 4 min末物质的量/ihol | 1.6 | 2.8 | a |
| 平衡物质的量/mol | 1 | b | 2 |
| A. | a=0.8 | |
| B. | t℃该反应的平衡常数为4 | |
| C. | 前4min内,用Z的变化量表示的平均反应速率V(Z)=0.1mol•L-1•min-1 | |
| D. | 升高平衡后的体系温度,V逆:增大,V正增大,平衡向逆反应方向移动 |
13.有两种有机物Q( )与P(
)与P( ),下列有关它们的说法中正确的是( )
),下列有关它们的说法中正确的是( )
 )与P(
)与P( ),下列有关它们的说法中正确的是( )
),下列有关它们的说法中正确的是( )| A. | 二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3:1 | |
| B. | 二者在NaOH醇溶液中均可发生消去反应 | |
| C. | 一定条件下,二者在NaOH溶液中均可发生取代反应 | |
| D. | Q的一氯代物只有1种,P的一溴代物有2种 |

 .
.