题目内容
18.SO2是造成空气污染的主要原因之一,利用钠碱循环法可除去SO2.(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是SO32-+SO2+H2O=2HSO3-.
(2)已知常温下,H2SO3的电离常数为 K1=1.54×10-2,K2=1.02×10-7,H2CO3的电离常数为 K1=4,.30×10-7,K2=5.60×10-11,则下列微粒可以大量共存的是bc(选填编号).
a.CO32-HSO3- b.HCO3-HSO3-c.SO32-HCO3-d.H2SO3HCO3-
(3)已知NaHSO3溶液显酸性,解释原因亚硫酸氢根的电离程度大于水解程度,在NaHSO3稀溶液中各离子浓度从大到小排列顺序是Na+>HSO3->H+>SO32->OH-.
(4)实验发现把亚硫酸氢钠溶液放置在空气中一段时间,会被空气中的氧气氧化,写出该反应的离子方程式2HSO3-+O2=2SO42-+2H+.
(5)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为NaI(填化学式).
(6)如果用含等物质的量溶质的下列溶液分别吸收SO2,则理论吸收量由多到少的顺序是c=b>a(用编号排序).
a.Na2SO3 b. Na2S c.酸性KMnO4.
分析 (1)SO2被Na2SO3溶液吸收生成亚硫酸氢钠;
(2)根据Ka越大酸性越强,根据酸性较强的能与酸性较弱的酸根离子反应;
(3)根据电离和水解程度的相对大小分析;既电离又水解,以电离为主,溶液显酸性;
(4)+4价的硫元素能被氧气氧化为+6价;
(5)根据过量NaHSO3溶液的还原性和I2的氧化性能继续发生氧化还原反应来分析反应产物;
(6)依据选项中的溶液性质和二氧化硫反应的过程和化学方程式定量关系分析计算.
解答 解:(1)SO2被Na2SO3溶液吸收生成亚硫酸氢钠,离子反应为SO32-+SO2+H2O=2HSO3-,
故答案为:SO32-+SO2+H2O=2HSO3-;
(2)已知Ka越大酸性越强,酸性较强的能与酸性较弱的酸根离子反应,由于HCO3-的酸性小于HSO3-的酸性,所以HCO3-与SO32-不反应,即bc能共存,
故答案为:bc;
(3)HSO3-在溶液中电离出氢离子,同时HSO3-能水解,由于电离程度大于水解程度,所以溶液显酸性;HSO3-既电离又水解,以电离为主,溶液显酸性,则溶液中的离子浓度大小关系为:Na+>HSO3->H+>SO32->OH-;
故答案为:亚硫酸氢根的电离程度大于水解程度;Na+>HSO3->H+>SO32->OH-;
(4)+4价的硫元素能被氧气氧化为+6价,则亚硫酸氢钠溶液放置在空气中一段时间,会被空气中的氧气氧化,其反应的离子方程式为:2HSO3-+O2=2SO42-+2H+;
故答案为:2HSO3-+O2=2SO42-+2H+;
(5)NaIO3溶液中滴加过量NaHSO3溶液时,I2能与NaHSO3发生氧化还原反应,碘元素的化合价降低,则还原产物为NaI,
故答案为:NaI;
(6)如果用含等物质的量溶质的下列各溶液分别来吸收SO2,则理论吸收量由多到少的顺序是
a.Na2SO3 吸收二氧化硫发生的反应为:Na2SO3+SO2+H2O=2NaHSO3,1molNa2SO3 最多吸收二氧化硫1mol;
b.Na2S 吸收二氧化硫发生的反应为:2Na2S+5SO2+2H2O=4NaHSO3+3S↓,1mol2Na2S最多反应二氧化硫2.5mol;
c.酸性KMnO4溶液吸收二氧化硫的反应2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,1molKMnO4最多反应二氧化硫2.5;
则吸收二氧化硫理论吸收量由多到少的顺序是c=b>a,
故答案为:c=b>a.
点评 本题考查了硫元素及其化合物的性质,题目难度中等,题目涉及元素化合物的性质、盐的水解原理的应用、电离常数的应用、离子浓度大小比较等,侧重于考查学生的分析能力和对基础知识的综合应用能力.

 阅读快车系列答案
阅读快车系列答案①液氯、干冰、磁性氧化铁均为化合物
②氢氟酸、盐酸、水玻璃均为混合物
③明矾、小苏打、烧碱均为电解质
④牛奶、豆浆、漂粉精均为胶体
⑤Na2O2、Na2CO3、Na2SiO3均为钠盐.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②③⑤ |
| A. | 电解质:水溶液是否导电 | |
| B. | 原子晶体:构成晶体的微粒是否是原子 | |
| C. | 共价分子:分子中原子间是否全部是共价键 | |
| D. | 化学平衡状态:平衡体系中各组分的物质的量浓度是否相等 |
(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
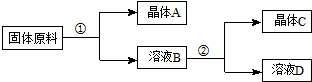
以下说法错误的是( )
| A. | ①和②的实验过程中,都需要控制温度 | |
| B. | ①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| C. | ②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤 | |
| D. | 用95%的酒精洗涤所得的硝酸钾晶体比较好 |
| A. | CH2=CHCOOH | B. | C15H31COOH | C. | C17H33COOH | D. | C17H35COOH |
| A. | 浓硝酸 | B. | 氢氟酸 | C. | 氢氧化钠溶液 | D. | 硝酸银固体 |
| A. | 先通过足量澄清石灰水,再通过足量品红溶液 | |
| B. | 先通过足量饱和NaHCO3溶液,再通过澄清石灰水 | |
| C. | 先通过足量NaOH溶液,再通过澄清石灰水 | |
| D. | 先通过足量酸性KMnO4溶液,再通过澄清石灰水 |