题目内容
4.前几年我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图为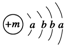 ,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
,X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.(1)m=20,该融雪剂的化学式为CaCl2.用电子式表示该融雪剂微粒的形成过程:
 .
.(2)Z、W元素的名称为硫、碳.
(3)下列说法正确的是B.
A.XY2和WZ2都为离子化合物 B.XY2分子中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强 D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是B.
A.XY2的电子式:X2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Y}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{Y}}{••}$${\;}_{•}^{•}$]2- B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-═2Y+Z↓
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因水分子之间存在氢键.
分析 X原子的结构示意图为 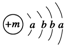 ,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2,据此解答.
,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2,据此解答.
解答 解:X原子的结构示意图为 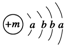 ,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2.
,由于K最多容纳2个电子,L层最多容纳8个电子,可知a=2,b=8,故X为Ca元素;由化学XY2可知Y的化合价为-1价,而X的阳离子与Y的阴离子的电子层结构相同,离子核外电子数均为18,则Y原子核外电子数为17,故Y为Cl,则该融雪剂为CaCl2;元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,符合条件的元素有He、C、S,由于Z与Y相邻且Z、W能形成一种WZ2型分子,则Z为S元素,W为C元素,二者形成的分子为CS2.
(1)由上述分析可知,m=2+8+8+2=20,该融雪剂的化学式为CaCl2,用电子式表示氯化钙的形成过程: ,
,
故答案为:20;CaCl2; ;
;
(2)由上述分析可知,Z为硫元素、W为碳元素,
故答案为:硫;碳;
(3)A.CaCl2属于离子化合物,而CS2是共价化合物,故A错误;
B.CaCl2中仅含离子键,CS2中只含共价键,且是极性共价键,故B正确;
C.因氯的非金属性强于硫,所以稳定性HCl>H2S,故C错误;
D.核外电子排布相同的离子,核电荷数越大,离子的半径越小,所以半径Ca2+<Cl-,故D错误,
故选:B;
(4)A.CaCl2为离子化合物,电子式为: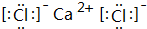 ,故A错误;
,故A错误;
B.CS2是直线形分子,结构式为S=C=S,故B正确;
C.Cl2与H2S水溶液反应的离子方程式为:Cl2+H2S═2H++2Cl-+S↓,故C错误,
故选:B;
(5)冰雪的化学成分是H2O,水的沸点比H2S的沸点高,是由于水分子之间存在氢键,
故答案为:水分子之间存在氢键.
点评 本题考查的知识点较多,涉及核外电子排布、电子式、化学键、元素周期律、微粒半径比较等,难度不大,根据核外电子排布和原子结构推导出元素是解题的关键,注意对基础知识的掌握.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | Al(OH)3 | B. | Fe(OH)3 | C. | Na2O | D. | FeCl2 |
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
| A. | NaCl和AgNO3 | B. | Na2CO3和稀盐酸 | C. | Al2(SO4)3和NaOH | D. | 盐酸和Na[Al(OH)4] |
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
kI O3+5KI+3H2 SO4=3K2 SO4+3I2+3H2O
上述反应生成的I2可用四氯化碳检验:确认有I2生成的现象是CCl4层呈紫色
利用Na2SO3稀溶液,将I2还原,可从碘的四氯化碳溶液中回收四氯化碳.Na2SO3稀溶液与I2反应的离子方程式为I2+SO32-+H2O=2I-+SO42-+2H+.
(2)已知:I2+2S2O32-=2I-+S4O62-某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中恰好完全反应依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是多少?(写出计算过程)
③根据以上实验和包装袋说明测得精制盐的碘(I)含量(以含w的代数式表示,单位为mg/kg).(写出计算过程)
| A. | 向Fe、FeO和Fe2O3的混合物中加入过量的盐酸 | |
| B. | 等物质的量的 NaHCO3溶液与 Na2O2固体 | |
| C. | 等物质的量浓度、等体积的(NH4)2SO4与 BaC12溶液 | |
| D. | 在NaBr溶液中通入过量氯气 |
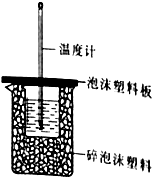 (1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.
(1)某同学想通过测定反应过程中所放出的热量来计算中和热,他将50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.①从实验装置上看,图中尚缺少的一种仪器是环形玻璃搅拌棒.
②大烧杯上如不盖硬纸板,则求得的中和热数值偏小(填“偏大”、“偏小’、“无影响”)
③实验中,所用NaOH稍过量的原因是保证盐酸能够完全被中和.
(2)某化学二兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大.小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证.
①猜想Ⅰ:此反应过程放热,促使反应速率加快;(填放热或吸热)
②草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O.
③猜想Ⅱ可是:生成的Mn2+对该反应有催化作用,加快反应速率,要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂X及秒表,试剂X是B.
A.K2MnO4 B.MnSO4 C.MnO2
④基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容.
| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL0.05mol/L 酸性KMnO4,少量X |
| 实验现象 (间) | A大于B(填大于或小于) | |
| 结论 | 猜想Ⅱ正确 | |

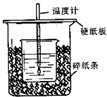 用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.已知比热容是4.18J/(g.℃).回答下列问题:
用50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.已知比热容是4.18J/(g.℃).回答下列问题: