题目内容
10.试写出下列反应的化学方程式.(1)吸收尾气Cl2:Cl2+2NaOH=NaCl+NaClO+H2O
(2)工业制备漂白粉:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
(3)漂白粉在空气中失效:Ca(ClO)2+C02+H20=2HClO+CaC03、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+02↑.
分析 (1)氢氧化钠与氯气反应生成氯化钠和次氯酸钠、水;
(2)氯气与石灰乳反应生成氯化钙、次氯酸钙和水;
(3)次氯酸钙与二氧化碳、水反应生成次氯酸和碳酸钙,次氯酸见光分解生成氯化氢和氧气.
解答 解:(1)氢氧化钠与氯气反应生成氯化钠和次氯酸钠、水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)氯气与石灰乳反应生成氯化钙、次氯酸钙和水,该反应为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)次氯酸钙和二氧化碳、水反应生成次氯酸,次氯酸不稳定,光照易分解,导致漂白粉失效,反应方程式为Ca(ClO)2+C02+H20=2HClO+CaC03、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+02↑,故答案为:Ca(ClO)2+C02+H20=2HClO+CaC03、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+02↑.
点评 本题考查了化学方程式的书写,为高频考点,把握氯气、次氯酸钙、次氯酸等物质的化学性质为解答的关键,注意根据反应原理找出反应物、生成物、反应条件,题目难度不大.

练习册系列答案
相关题目
18.在一定条件下,下列有机物中能发生加成反应、取代反应、水解反应和酯化反应的是( )
| A. | 一滴香: | B. | 扑热息痛: | C. | 维生素B5 | D. | 芬必得: |
5.在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积,则平衡后溶液中( )
| A. | C(Ba2+)=C(SO42-)=Ksp½ | |
| B. | C(Ba2+)•C(SO42-)>Ksp C(Ba2+)=C(SO42-) | |
| C. | C(Ba2+)•C(SO42-)=Ksp C(Ba2+)>C(SO42-) | |
| D. | C(Ba2+)•C(SO42-)≠Ksp C(Ba2+)<C C(SO42-) |
2.某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2g H2O.下列说法正确的是( )
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:8 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定含有氧元素 |
19.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
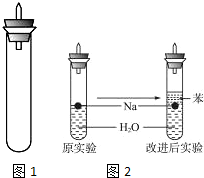 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图: