题目内容
16.下列说法不正确的是( )| A. | 治理拥堵,减少汽车尾气排放,大力发展清洁能源可以有效减少雾霾 | |
| B. | 铜的金属活动性比铝弱,可以用铜罐代替铝罐储运浓硝酸 | |
| C. | 光化学烟雾的形成和氮的氧化物有关,硫的氧化物是形成硫酸型酸雨的主要物质 | |
| D. | 硫化钠和亚硫酸钠的固体如果长期暴露在空气中容易变质 |
分析 A.汽车尾气排放是引起雾霾原因之一;
B.铜与浓硝酸发生氧化还原反应,铝遇到冷的浓硝酸钝化;
C.依据光化学烟雾、酸雨成因解答;
D.硫离子、亚硫酸根离子具有强还原性,容易被氧气氧化.
解答 解:A.治理拥堵,减少汽车尾气排放,大力发展清洁能源,能够减少空气污染物的排放,有效减少雾霾,故A正确;
B.铜与浓硝酸发生氧化还原反应,铝遇到冷的浓硝酸钝化,所以不能用铜制容器运输浓硝酸,可以用铝制容器储运浓硝酸,故B错误;
C.光化学烟雾的形成和氮的氧化物有关,硫的氧化物是形成硫酸型酸雨的主要物质,故C正确;
D.硫离子、亚硫酸根离子具有强还原性,容易被氧气氧化,所以硫化钠和亚硫酸钠的固体如果长期暴露在空气中容易变质,故D正确;
故选:B.
点评 本题考查了元素化合物知识,环境污染与保护,熟悉相关物质的性质、酸雨、光化学烟雾、雾霾的成因是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.实验室欲配制100mL 0.5mol/L的NaOH溶液,配制过程中的下列做法会使所配浓度偏高的是( )
| A. | 称量NaOH固体时,放在烧杯中且称量较慢 | |
| B. | 定容时,俯视刻度线 | |
| C. | 定容时,加水超过刻度线,再用胶头滴及将过线的液体吸出 | |
| D. | 移液前,容量瓶中有少量蒸馏水 |
4.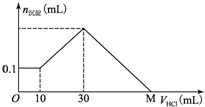 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )
 某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )
某一固体物质可能由NaOH、AlCl3、MgCl2中的几种组成,取一定量该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol/L的盐酸,如图表示沉淀量随盐酸加入量的变化关系,图中M点表示已加入的盐酸的体积,则M点的体积是( )| A. | 70 mL | B. | 100 mL | C. | 120 mL | D. | 130 mL |
11.若1gCO2中含有x个原子,则阿伏加德罗常数可表示为( )
| A. | $\frac{1}{44}$mol-1 | B. | $\frac{x}{22}$mol-1 | C. | $\frac{3x}{44}$mol-1 | D. | $\frac{44x}{3}$mol-1 |
1.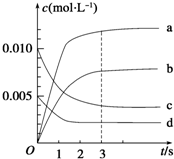 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
(1)能说明该反应已经达到平衡状态的是bc
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是b,
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是ac
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)△H<0,体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(2)图中表示NO2的变化的曲线是b,
(3)用O2的浓度变化表示从0~2s内该反应的平均速率v=0.0015mol•L-1•s-1.
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是ac
a.将容器体积变为1Lb.适当升高温度c.增大O2的浓度d.选择高效的催化剂.
5.下列是某同学的设计的家庭小实验,其中不能成功的是( )
| A. | 用小苏打检验面团发酵产生的酸 | |
| B. | 用碘酒证明马铃薯中含有淀粉 | |
| C. | 用食醋除去热水瓶中的水垢 | |
| D. | 用淀粉直接检验加碘盐中含的碘元素 |
6. 向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
 向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgC12和A1C13的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )| A. | a、c两点沉淀物成份不相同,d、e两点沉淀物成份相同 | |
| B. | b点溶液的中c(Na+)=c(C1-) | |
| C. | b-c段与c-d段溶液中阴离子的物质的量相等 | |
| D. | 在d点,向溶液中加入少量盐酸,沉淀量将减少 |
 甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊的负一价阴离子与丙的阳离子差8个电子.甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质, .
.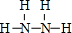 ;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+2H2O.
;该物质与空气在碱性条件下可构成燃料电池,该电池放电时,负极的反应式为N2H4+4OH--4e-=N2↑+2H2O.

 .
.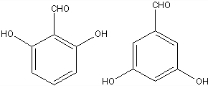 、
、 (任意一种).
(任意一种).