题目内容
16.Li原子核外有3个电子,则Li元素最多有几个不同电离能( )| A. | 1个 | B. | 2个 | C. | 3个 | D. | 无法判断 |
分析 电离能是指处于基态的气态原子失去一个电子生成+1价的气态阳离子所需要的能量称为第一电离能(I1).由+1价气态阳离子再失去一个电子形成+2价气态阳离子时所需能量称为元素的第二电离能(I2),第三、四电离能依此类推,据此答题.
解答 解:电离能是指处于基态的气态原子失去一个电子生成+1价的气态阳离子所需要的能量称为第一电离能(I1).由+1价气态阳离子再失去一个电子形成+2价气态阳离子时所需能量称为元素的第二电离能(I2),第三、四电离能依此类推,Li原子核外有3个电子,所以有三个不同电离能,故选C.
点评 本题主要考查电离能的概念,难度不大,注重对基础知识和基本概念的理解.

练习册系列答案
相关题目
6.已知24mL浓度为0.05mol/L 的Na2SO3溶液恰好与V mL浓度为0.02mol/L的K2Cr2O7溶液完全反应;又知Na2SO3被K2Cr2O7氧化为Na2SO4,元素Cr在还原产物中的化合价为+3价,则所需K2Cr2O7溶液体积V为( )
| A. | 10 | B. | 20 | C. | 30 | D. | 40 |
4.常温下将0.1mol/L 醋酸与0.1mol/L NaOH溶液等体积混合,所得溶液( )
| A. | c(Na+)=c(CH3COO-) | B. | pH>7 | C. | pH=7 | D. | pH<7 |
1. 25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )
25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )
 25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )
25℃时,氢氟酸的电离常数Ka=6.8×10-4mol•L-1,醋酸的电离常数Ka=1.8×10-5mol•L-1,如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系,则Y可以表示( )| A. | 溶液的pH | B. | 水解平衡常数 | ||
| C. | 水解百分率 | D. | 溶液中阴离子浓度之和 |
5.已知在常温下,存在下列化学反应:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
2FeCl3+2KI═2FeCl2+2KCl+I2
2FeCl2+Cl2═2FeCl3
则下列各物质还原性由强到弱排列的顺序正确的是( )
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
2FeCl3+2KI═2FeCl2+2KCl+I2
2FeCl2+Cl2═2FeCl3
则下列各物质还原性由强到弱排列的顺序正确的是( )
| A. | I-,Fe2+,Cl-,Mn2+ | B. | Cl-,Mn2+,I-,Fe2+ | ||
| C. | Mn2+,Cl-,I-,Fe2+ | D. | MnO4-,Cl2,Fe3+,I2 |
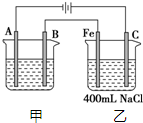 如图所示为相互串联的甲、乙两电解池.试回答:
如图所示为相互串联的甲、乙两电解池.试回答: