题目内容
5.已知在常温下,存在下列化学反应:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
2FeCl3+2KI═2FeCl2+2KCl+I2
2FeCl2+Cl2═2FeCl3
则下列各物质还原性由强到弱排列的顺序正确的是( )
| A. | I-,Fe2+,Cl-,Mn2+ | B. | Cl-,Mn2+,I-,Fe2+ | ||
| C. | Mn2+,Cl-,I-,Fe2+ | D. | MnO4-,Cl2,Fe3+,I2 |
分析 氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,据此分析.
解答 解:由2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,则还原性HCl>MnCl2,
2KI+2FeCl3═2KCl+I2+2FeCl2中,还原性I->Fe2+,
Cl2+2FeCl2═2FeCl3中,还原性Fe2+>Fe3+,
则还原性I->Fe2+>Cl->Mn2+,
故选A.
点评 本题考查氧化还原反应,侧重于学生的分析能力和基础知识的考查,注意把握氧化性、还原性的大小比较,难度不大.

练习册系列答案
相关题目
15.下列说法中正确的是( )
| A. | 原子最外层电子数大于4的元素不一定是非金属元素 | |
| B. | 同周期的主族元素从左到右,非金属性逐渐增强,气态氢化物稳定性逐渐减弱 | |
| C. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素不一定是金属元素 | |
| D. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 |
16.Li原子核外有3个电子,则Li元素最多有几个不同电离能( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 无法判断 |
17.0.2mol某有机物和0.4mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻了3.2g;最后气体再通过碱石灰被完全吸收,碱石灰增重17.6g.该有机物的化学式为( )
| A. | C2H6 | B. | C2H6O | C. | C2H6O2 | D. | C3H6O3 |
14. 常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( )
常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( )
 常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( )
常温下pH=2的两种酸溶液A和B,分别加水稀释1000倍,其pH值与所加水的体积变化如图所示.下列结论正确的是( )| A. | 酸B比酸A的电离度大 | B. | A为弱酸,B为强酸 | ||
| C. | 酸B的物质的量浓度比A的小 | D. | A酸比B酸易电离 |

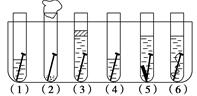 取6根铁钉、6支洁净试管及其他材料,按图所示准备.
取6根铁钉、6支洁净试管及其他材料,按图所示准备. .
.