题目内容
8.火箭推进剂由肼(N2H4)和液态过氧化氢组成,当它们混合反应时,即产生大量N2和H2O(g),并放出大量的热量.已知0.4mol液态肼与足量液态H2O2反应,生成N2和H2O(g)并放出256.65kJ热量.(1)反应的热化学方程式为N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
(2)反应中的氧化剂是2H2O2;
(3)当放出256.65kJ热量时,转移电子数1.6NA;
(4)此燃料的优点是污染小,产生的热量多.
分析 (1)根据物质的量之比等于热量比计算出1molN2H4完全放出的热量,依据热化学方程式书写方法写出,标注物质聚集状态和反应焓变;
(2)反应H2O2中O元素的化合价从-1价降低到-2价;
(3)根据热化学方程式计算出放出256.65kJ热量时,反应的双氧水的物质的量,结合化合价的变化计算转移电子数;
(4)根据产物的性质分析.
解答 解:(1)0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量,32g肼燃烧放热641.625kJ;肼燃烧的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625kJ/mol;
(2)反应H2O2中O元素的化合价从-1价降低到-2价,H2O2得电子,作氧化剂;
故答案为:H2O2;
(3)放出256.65kJ热量时,反应的双氧水的物质的量为$\frac{256.65kJ}{641.625kJ/mol}$×2=0.8mol,则转移电子的物质的量为1.6mol,转移电子数1.6NA;
故答案为:1.6NA;
(4)肼(N2H4)和液态过氧化氢反应产生大量N2和H2O(g),并放出大量的热量,反应产物无污染,故答案为:污染小,产生的热量多.
点评 本题考查了反应热的计算、热化学方程式的书写、氧化还原反应,题目难度不大,注意把握热化学方程式书写方法和氧化还原反应的原理.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
18.下列叙述正确的是( )
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2不与铁反应 | |
| C. | 氯气具有漂白性 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
19.下列离子方程式不正确的是( )
| A. | 向100mL0.1mol•L-1的Na2CO3溶液中滴加含0.01molCH3COOH的醋酸溶液CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积均匀混合4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 等物质的量的FeBr2与Cl2反应(已知:Br2+2Fe2+═2Fe3++2 Br-,Cl2+2Br-═Br2+2Cl-):2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 向NaAlO2溶液中通入过量CO2的反应:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
16.Li原子核外有3个电子,则Li元素最多有几个不同电离能( )
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 无法判断 |
3.下列有关化学用语表示正确的是( )
| A. | 二氧化碳的分子式: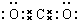 | |
| B. | Cl-的结构示意图: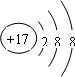 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | 质子数为53、中子数为78 的碘原子:${\;}_{53}^{131}$I |
17.0.2mol某有机物和0.4mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8g;再通过灼热CuO充分反应后,固体质量减轻了3.2g;最后气体再通过碱石灰被完全吸收,碱石灰增重17.6g.该有机物的化学式为( )
| A. | C2H6 | B. | C2H6O | C. | C2H6O2 | D. | C3H6O3 |
18.下列说法不正确的是( )
| A. | 医用酒精的浓度通常为75% | |
| B. | 用灼烧并闻气味的方法区别纯棉织物和纯毛织物 | |
| C. | 采集某雨水样品,放置一段时间,pH由4.8变为4.2,是因为水中溶解了较多的CO2 | |
| D. | 氢氧化铝和碳酸氢钠都可以作为治疗胃酸过多的药剂 |

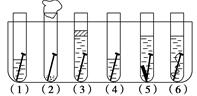 取6根铁钉、6支洁净试管及其他材料,按图所示准备.
取6根铁钉、6支洁净试管及其他材料,按图所示准备.