题目内容
15.下列实验方法能达到目的是( )| A. | 用氨水清洗试管内壁附着的银镜 | |
| B. | 将NH4Cl溶液蒸干制备NH4Cl固体 | |
| C. | 鉴别氯化钠溶液、氢氧化钠溶液和稀盐酸,各取少量溶液于试管中,分别滴加紫色石蕊溶液,观察溶液颜色的变化 | |
| D. | 制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
分析 A.银与氨水不反应;
B.加热生成氯化铵分解;
C.氯化钠溶液、氢氧化钠溶液和稀盐酸分别为中性、碱性、酸性;
D.长时间煮沸胶体易聚沉.
解答 解:A.银与氨水不反应,应选稀硝酸清洗试管内壁附着的银镜,故A错误;
B.加热生成氯化铵分解,应冷却结晶制备NH4Cl固体,故B错误;
C.氯化钠溶液、氢氧化钠溶液和稀盐酸分别为中性、碱性、酸性,加石蕊的颜色分别为紫色、蓝色、红色,可鉴别,故C正确;
D.长时间煮沸胶体易聚沉,出现红褐色液体可停止加热,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、物质的制备、物质的鉴别、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
3.下列反应中反应物键能总和高于生成物键能总和的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇的燃烧 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 氧化钙与水反应 |
10.钠及其化合物具有广泛的用途.
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
上述盐溶液中的阴离子,结合氢离子能力最强的是CO32-;根据表中数据,浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最大的是C(填序号).
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:①<②(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:①<②.
(3)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有.
②几种离子开始沉淀时的pH如表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加氢氧化钠溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)3]<Ksp[Mg(OH)2](填“>”“=”或“<”),要使0.2mol/L硫酸铜溶液中铜离子沉淀较为完全(使铜离子浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为6.( Ksp[Cu(OH)2]=2×10-20 )
(1)常温下,浓度均为0.1mol/L的下列五种钠盐溶液的pH如表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.CH3COOH D.H2CO3
(2)有①100mL0.1mol/L碳酸氢钠 ②100mL0.1mol/L碳酸钠两种溶液,溶液中水电离出的氢离子个数:①<②(填“>”“=”“<”下同);溶液中阴离子的物质的量浓度之和:①<②.
(3)实验室中常用氢氧化钠来进行洗气和提纯.
①当150mL1mol/L的氢氧化钠溶液吸收标况下2.24L二氧化碳时,所得溶液中各离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有.
②几种离子开始沉淀时的pH如表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
20.在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,3.75mol CuSO4可氧化P的物质的量为( )mol?.生成2mol Cu3P 时,参加反应的P的物质的量为( ) mol?
| A. | 0.75,2.2 | B. | 1.5,2.2 | C. | 0.75,4.4 | D. | 1.5,4.4 |
7.在密闭容器中发生如下反应:mA(g)+nB(g)?pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.8倍,下列说法错误的是( )
| A. | m+n<p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率降低 | D. | C的体积分数增加 |
4.下列仪器不能用于加热的是( )
| A. | 容量瓶 | B. | 蒸馏烧瓶 | C. | 试管 | D. | 烧杯 |
5.一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2OCH3COOH+OH-,下列说法正确的是( )
| A. | 加入少量NaOH固体,c(CH3COO-)增大 | |
| B. | 加入少量FeCl3固体,c(CH3 COO-)增大 | |
| C. | 稀释溶液,溶液的pH增大 | |
| D. | 加入适量醋酸得到的酸性混合溶液:c( Na+)>c(CH3COO-)>c(H+)>c( OH-) |
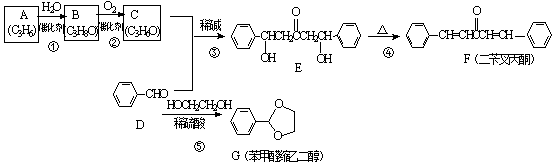
 ;A加聚产物的结构简式是
;A加聚产物的结构简式是 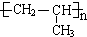 .
.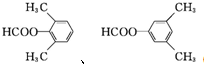 .
.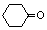 (环已酮)合成
(环已酮)合成 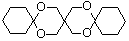 [已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]
[已知HCHO是所有醛中还原性最强的(常用Ca(OH)2催化剂)]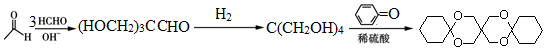 .
.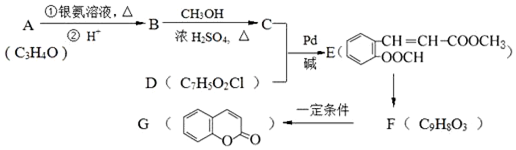

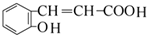 .
.
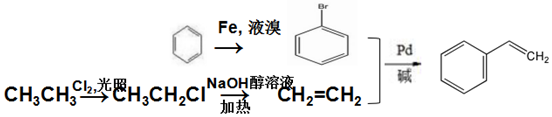 .
.