题目内容
某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
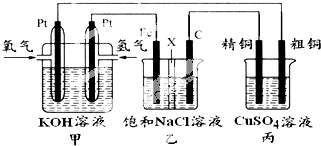
根据要求回答相关问题:
(1)通入氢气的电极为 极,其电极反应式为 .
(2)乙装置中石墨电极的电极反应式为 .反应一段时间后,在乙装置中滴入酚酞溶液, 区(填“铁极”或“石墨极”)的溶液先变红.通过X的离子是 .电解一段时间后若要恢复原溶液的成分和浓度,应该采用 的办法.
(3)若在标准状况下,有224ml氧气参加反应,则乙装置中铁电极上生成的气体的分子数为 ;丙装置中阴极析出产物的质量为 .如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 (填“增大”“减小”或“不变”).

根据要求回答相关问题:
(1)通入氢气的电极为
(2)乙装置中石墨电极的电极反应式为
(3)若在标准状况下,有224ml氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
考点:原电池和电解池的工作原理
专题:
分析:(1)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,负极上失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(2)石墨电极为阳极,石墨上氯离子失电子;Fe为阴极,阴极上氢离子放电,同时电极附近有氢氧根离子生成,溶液呈碱性;X为阳离子交换膜,钠离子和氢离子可以通过;电解后要恢复原溶液则要加入HCl;
(3)根据串联电路中转移电子相等进行计算.
(2)石墨电极为阳极,石墨上氯离子失电子;Fe为阴极,阴极上氢离子放电,同时电极附近有氢氧根离子生成,溶液呈碱性;X为阳离子交换膜,钠离子和氢离子可以通过;电解后要恢复原溶液则要加入HCl;
(3)根据串联电路中转移电子相等进行计算.
解答:
解:(1)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,负极上失电子发生氧化反应,电极反应为H2-2e-+2OH-═2H2O,
故答案为:负;H2-2e-+2OH-═2H2O;
(2)石墨电极为阳极,阳极的电极反应式为:2Cl--2e-=Cl2↑;铁电极作阴极,阴极上氢离子放电,同时电极附近有氢氧根离子生成,溶液呈碱性,无色酚酞试液在铁极附近变红色;X为阳离子交换膜,钠离子和氢离子可以通过;电解时从溶液中析出氢气和氯气,则电解后要恢复原溶液则要加入适量的HCl;
故答案为:2Cl--2e-=Cl2↑;铁极;Na+、H+;通适量HCl;
(3)若在标准状况下,有2.24L氧气参加反应,乙装置中铁电极上氢离子放电生成氢气,根据转移电子守恒得
则乙装置中铁电极上生成的气体的分子数为=
×4×
×NA=1.204×1022,丙装置中阴极上铜离子得电子生成铜单质,
析出铜的质量═
×4×
×64g/mol=1.28g;电解精炼时,两极上转移的电子数相同,如果粗铜中含有锌、银等杂质,则析出的Cu的物质的量大于溶解的铜,则丙装置中反应一段时间后硫酸铜溶液浓度将减小;
故答案为:1.204×1022;1.28 g;减小.
故答案为:负;H2-2e-+2OH-═2H2O;
(2)石墨电极为阳极,阳极的电极反应式为:2Cl--2e-=Cl2↑;铁电极作阴极,阴极上氢离子放电,同时电极附近有氢氧根离子生成,溶液呈碱性,无色酚酞试液在铁极附近变红色;X为阳离子交换膜,钠离子和氢离子可以通过;电解时从溶液中析出氢气和氯气,则电解后要恢复原溶液则要加入适量的HCl;
故答案为:2Cl--2e-=Cl2↑;铁极;Na+、H+;通适量HCl;
(3)若在标准状况下,有2.24L氧气参加反应,乙装置中铁电极上氢离子放电生成氢气,根据转移电子守恒得
则乙装置中铁电极上生成的气体的分子数为=
| 0.224L |
| 22.4L/mol |
| 1 |
| 2 |
析出铜的质量═
| 0.224L |
| 22.4L/mol |
| 1 |
| 2 |
故答案为:1.204×1022;1.28 g;减小.
点评:本题考查了原电池和电解池知识,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该题的关键,结合串联电路的特点解答该题,题目难度中等.

练习册系列答案
相关题目
钢铁发生腐蚀时,正极上发生的反应是( )
| A、2Fe-4e-=2Fe2+ |
| B、2Fe2++4e-=2Fe |
| C、2H2O+O2+4e-=4OH- |
| D、Fe3++e-=Fe2+ |
由钠和氧组成的某种离子晶体含钠的质量分数是69/109,其阴离子只有过氧离子(O22-)和氧离子(O2-)两种.在此晶体中,氧离子和超氧离子的物质的量之比为( )
| A、2:1 | B、1:2 |
| C、1:1 | D、1:3 |
下列各组物质中,第一种是酸,第二种是碱,第三种是的是混合物( )
| A、硫酸、CuSO4?5H2O、苛性钾 |
| B、硫酸、纯碱、空气 |
| C、氧化铁、胆矾、熟石灰 |
| D、硝酸、烧碱、食盐水 |
在实验室用Zn与稀H2SO4反应来制取H2,常加少量CuSO4来加快反应速率.为了研究CuSO4的量对H2生成速率的影响,某同学设计了实验方案(见下表),将表中所给的试剂按一定体积混合后,分别加入四个盛有相同大小的Zn片(过量)的反应瓶(甲、乙、丙、丁)中,收集产生的气体,并记录收集相同体积的气体所需的时间.
下列说法正确的是( )
下列说法正确的是( )
| 试剂 实验 | 甲 | 乙 | 丙 | 丁 |
| 4mol?L-1H2SO4/mL | 20 | V1 | V2 | V3 |
| 饱和CuSO4溶液/mL | 0 | 2.5 | V4 | 10 |
| H2O/mL | V5 | V6 | 8 | 10 |
| 收集气体所需时间/s | t1 | t2 | t3 | t4 |
| A、t1<t2<t3<t4 |
| B、V4=V5=10 |
| C、V6=17.5 |
| D、V1<V2<V3<20 |