题目内容
17.一小块金属钠放入下列溶液中,既能产生气体又会生成白色沉淀的是( )| A. | 稀硫酸 | B. | 氢氧化钾稀溶液 | C. | 硫酸铜溶液 | D. | 饱和石灰水溶液 |
分析 根据钠的化学性质:与水、酸、盐溶液的反应,利用2Na+2H2O=2NaOH+H2↑及生成的碱与盐的反应来得出反应现象.
解答 解:A.钠与稀硫酸反应生成硫酸钠和氢气,不会产生沉淀,故A不选;
B.钠与氢氧化钾溶液反应实质钠与水反应生成氢氧化钠和氢气,不会产生沉淀,故B不选;
C.钠与硫酸铜溶液反应生成硫酸钠、氢氧化铜沉淀和水,产生气体生成蓝色沉淀,故C不选;
D.钠与饱和石灰水溶液中的水反应生成氢氧化钠和氢气,反应放热,氢氧化钙溶解度随着温度升高而降低,所以有白色固体析出,故D选;
故选:D.
点评 本题考查了元素化合物知识,明确钠与碱、盐的反应中首先考虑与溶液中的水反应,然后再看生成的氢氧化钠能否与碱、盐本身反应是解题关键,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
8.下列物质能够导电的是( )
①熔融的氯化钠 ②硝酸钾溶液 ③硫酸铜晶体 ④无水乙醇.
①熔融的氯化钠 ②硝酸钾溶液 ③硫酸铜晶体 ④无水乙醇.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
5.下列处置、操作或现象的描述中正确的是( )
| A. | 用pH试纸测量新制氯水的pH | |
| B. | 用托盘天平称量5.57gKCl固体 | |
| C. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| D. | 有大量的氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向高处跑 |
12.关于下列分子的说法不正确的是( )
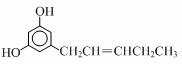
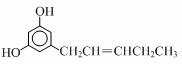
| A. | 既有σ键又有π键 | |
| B. | O-H键的极性比强于C-H键的极性 | |
| C. | 是非极性分子 | |
| D. | 该物质的分子之间不能形成氢键,但它可以与水分子形成氢键 |
2.盐酸在不同的反应中,起到不同作用,下列反应中盐酸同时表现出氧化性和还原性的是( )
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ |
9.下列有关烃的叙述正确的是( )
| A. | 分子通式为CnH2n+2的烃不一定是烷烃 | |
| B. | 烯烃在适宜的条件下只能发生加成反应,不能发生取代反应 | |
| C. | 在烷烃分子中,所有的化学键都是单键 | |
| D. | 分子式是C4H8的烃分子中一定含有碳碳双键 |
6.如表是不同温度下水的离子积数据:
试回答以下几个问题:
(1)若25<t1<t2,则a>1×10-14(填“<”、“>”或“=”),由此判断的理由是:水的电离为吸热反应,升高温度,平衡向着正反应方向移动.
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:10-10mol•L-1.
| 温度/℃ | 25 | t1 | t2 |
| Kw/mol2•L-2 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“<”、“>”或“=”),由此判断的理由是:水的电离为吸热反应,升高温度,平衡向着正反应方向移动.
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:10-10mol•L-1.
7.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2.24LCO或N2所含的电子数为1.4NA | |
| B. | 标准状况下,22.4升H2O中所含分子数小于NA | |
| C. | 常温常压下,33.6L氯气与56 g铁充分反应,转移的电子数为3NA | |
| D. | 常温常压下,1.8 g H2O含有的质子数为NA |