题目内容
2.盐酸在不同的反应中,起到不同作用,下列反应中盐酸同时表现出氧化性和还原性的是( )| A. | Zn+2HCl═ZnCl2+H2↑ | B. | MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ |
分析 存在元素化合价变化的化学反应是氧化还原反应,元素的化合价升高失电子,表现还原性,元素的化合价降低得电子表现氧化性,据此分析解答.
解答 解:A.Zn+2HCl═ZnCl2+H2↑,反应中H元素的化合价降低,HCl表现氧化性,不表现还原性,故A错误;
B.MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,该反应HCl中Cl元素化合价升高,HCl表现还原性,故B错误;
C.NaOH+HCl═NaCl+H2O,该反应中没有元素化合价变化,所以不是氧化还原反应,故C错误;
D.2HCl$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑,该反应H元素化合价降低,表现氧化性,Cl元素化合价升高,表现还原性,故D正确;
故选D.
点评 本题考查了氧化还原反应,侧重于物质氧化性和还原性判断的考查,明确基本概念内涵是解本题关键,根据元素化合价是否变化来分析解答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.在容积为2L的密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示.下列说法正确的是( )
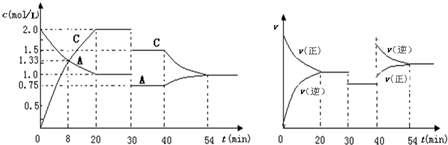

| A. | 0~20min用A物质表示反应的平均速率为0.005mol•L-1•min-1 | |
| B. | 该反应的正反应为吸热反应 | |
| C. | x=1,且30min时改变的反应条件是减压 | |
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |
13.下列反应的离子方程式错误的是( )
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| B. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O | |
| C. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+=Al3++3H2O | |
| D. | 过量CO2通入氢氧化钠溶液中:CO2+2OH-=CO32-+H2O |
10.下列化学用语表述不正确的是( )
| A. | HCl的电子式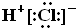 | B. | CH4的球棍模型: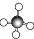 | ||
| C. | S2-的结构示意图为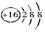 | D. | 乙烯的结构简式: |
17.一小块金属钠放入下列溶液中,既能产生气体又会生成白色沉淀的是( )
| A. | 稀硫酸 | B. | 氢氧化钾稀溶液 | C. | 硫酸铜溶液 | D. | 饱和石灰水溶液 |
7.下列说法正确的是( )
| A. | 氧化还原反应的实质是化合价的升降 | |
| B. | 同温同压下,任何气体的分子间距离几乎相等 | |
| C. | 布朗运动是胶体区别于其他分散系的本质特征 | |
| D. | SO2的水溶液能够导电,所以SO2是电解质 |
14.下列应用不涉及氧化还原反应的是( )
| A. | 铝热法冶炼难熔金属 | B. | 实验室用NH4Cl和Ca(OH)2制备NH3 | ||
| C. | Na2O2用作呼吸面具的供氧剂 | D. | 工业上电解熔融状态Al2O3制备Al |
12.以下关于甲烷分子说法中错误的是( )
| A. | 甲烷分子是由非极性键构成的分子 | |
| B. | 甲烷分子具有正四面体结构 | |
| C. | 甲烷分子中四个C-H键是完全相同的键 | |
| D. | 甲烷分子和CCl4分子具有相同的空间结构 |