题目内容
7.在一个2L的密闭容器中,放入3molA(g)和2molB(g),在一定条件下发生下列反应:3A(g)+2B(g)═3C(g)+nD(g).反应进行到2s时,D的浓度为0.01mol/L.当反应达到平衡时,测得混合气体的压强为原来的$\frac{9}{10}$(保持容器内温度不变).则(1)该反应方程式中的n值是A(填代号).
A.1 B.2 C.3 D.4
(2)前2s,以C表示的平均化学反应速率为0.375mol/(L•min).
(3)达到平衡时,A的转化率为50%.
(4)达到平衡时,将容器容积压缩为原来的一半,重新达到平衡后,测得混合气体的压强为原来的21/25(保持容器内温度不变),则A的转化率为80%.
分析 (1)(2)(3)到平衡时,测得混合气体的压强为原来的$\frac{9}{10}$,则说明该反应为气体体积减小的反应,所以n=1,设转化了的A为3xmol,则
3A(g)+2B(g)?3C(g)+D(g)
起始(mol):3 2 0 0
转化(mol):3x 2x 3x x
平衡(mol):3-3x 2-2x 3x x
则有$\frac{3-3x+2-2x+3x+x}{5}$=$\frac{9}{10}$,据此求得x,进而可计算C表示的平均化学反应速率、转化率等物理量;
(4)将容器容积压缩为原来的一半,利用三段式可得平衡时各物质的物质的量,根据压强之比等于物质的量之比可求得转化的A的物质量,根据转化率=$\frac{已转化的量}{起始的量}$×100%进行计算;
解答 解:到平衡时,测得混合气体的压强为原来的$\frac{9}{10}$,则说明该反应为气体体积减小的反应,所以n=1,设转化了的A为3xmol,则
3A(g)+2B(g)?3C(g)+D(g)
起始(mol):3 2 0 0
转化(mol):3x 2x 3x x
平衡(mol):3-3x 2-2x 3x x
则有$\frac{3-3x+2-2x+3x+x}{5}$=$\frac{9}{10}$,据此求得x=0.5,
(1)根据上面的分析可知,n=1,故选A;
(2)前2s,以C表示的平均化学反应速率为$\frac{\frac{0.5×3}{2}}{2}$mol/(L•min)=0.375mol/(L•min),
故答案为:0.375mol/(L•min);
(3)达到平衡时,A的转化率为$\frac{3×0.5}{3}$×100%=50%,
故答案为:50%;
(4)将容器容积压缩为原来的一半,设转化了的A为3xmol,则
3A(g)+2B(g)?3C(g)+D(g)
起始(mol):3 2 0 0
转化(mol):3x 2x 3x x
平衡(mol):3-3x 2-2x 3x x
则有$\frac{3-3x+2-2x+3x+x}{5}$=$\frac{21}{25}$,据此求得x=0.8,所以A的转化率为$\frac{3×0.8}{3}$×100%=80%,
故答案为:80%.
点评 本题考查化学平衡的计算,题目难度不大,注意根据压强之比等于物质的量之比进行计算;

| 乙醇 | 溴乙烷 | 1-丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(2)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(3)制备操作中,加入的浓硫酸必需进行稀释,目的是abc.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于平衡向生成溴乙烷的方向移动;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大.
| A. | HCl、NaOH、Ba(OH)2 | B. | HCl、KOH、NaCl | C. | H2SO4、HCl、NaCl | D. | H2SO4、NaOH、KOH |
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉中进行(填设备名称).
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂且有热交换器的接触室(填设备名称)中进行反应.在如图所示的装置中,C处流出的气体有SO3、SO2、O2;SO3进入吸收塔(填设备名称)用98.3%的H2SO4吸收,得到浓硫酸或发烟硫酸.
(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是400℃,1个标准大气压.
| 压强/MPa SO2转化率 温度/℃ | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9989 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8528 | 0.8897 | 0.9276 | 0.9468 |
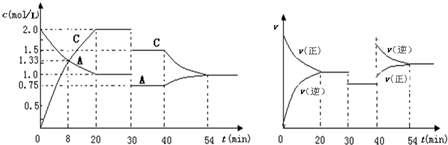
| A. | 0~20min用A物质表示反应的平均速率为0.005mol•L-1•min-1 | |
| B. | 该反应的正反应为吸热反应 | |
| C. | x=1,且30min时改变的反应条件是减压 | |
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反应达到平衡时,X的转化率为50% | |
| B. | 上述反应为X+3Y?2Z,其平衡常数为1600 | |
| C. | 增大压强使平衡向生成Z的方向移动,平衡常数不变 | |
| D. | 若改变温度反应的平衡常数变大,则一定为升高温度 |
| A. | 物质所含元素化合价升高的反应叫还原反应 | |
| B. | 在氧化还原反应中,失去电子的元素化合价降低 | |
| C. | 物质中某元素失去电子,则此物质是氧化剂 | |
| D. | 还原剂中必定有一种元素被氧化 |
| A. | 稀硫酸 | B. | 氢氧化钾稀溶液 | C. | 硫酸铜溶液 | D. | 饱和石灰水溶液 |