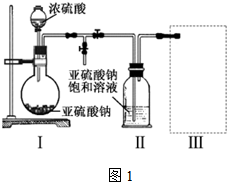
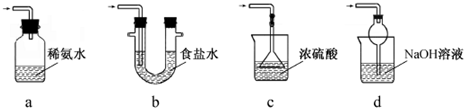
题目内容
9.J、L、R、T是原子序数依次增大的短周期主族元素,其中J、R、T在周期表中的相对位置如右表:J元素最外层电子数是电子层数的2倍.L与R同周期,且L在该周期中原子半径最大.| J | ||||
| R | T |
 .
.(2)写出L元素与T元索组成化合物的电子式
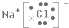 .
.(3)写出实验室制备单质T2的离子反应方程式MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)单质T2与石灰乳反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(5)单质L与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,放出热量215kJ.则该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1.
分析 J、L、R、T是原子序数依次增大的短周期主族元素,由J、R、T在周期表中的相对位置可知J在第二同期,R、T在第三周期,J元素最外层电子数是电子层数的2倍,则J最外层电子数是4,J为C,R为S,T为Cl,L与R同周期,且L在该周期中原子半径最大,同周期原子半径从左到右递减,所以L为Na,
根据以上分析可知:J为C、L为Na、R为S、T为Cl.
解答 解:J、L、R、T是原子序数依次增大的短周期主族元素,由J、R、T在周期表中的相对位置可知J在第二同期,R、T在第三周期,J元素最外层电子数是电子层数的2倍,则J最外层电子数是4,J为C,R为S,T为Cl,L与R同周期,且L在该周期中原子半径最大,同周期原子半径从左到右递减,所以L为Na,
根据以上分析可知:J为C、L为Na、R为S、T为Cl.
(1)R 2-的离子结构示意图为 ,
,
故答案为: ;
;
(2)氯化钠的电子式为: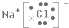 ,
,
故答案为: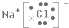 ;
;
(3)实验室用二氧化锰与浓盐酸在加热的条件下制氯气,反应的离子反应方程式为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)单质氯气与石灰乳反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)单质钠与水反应生成氢氧化钠和氢气,化学方程式为:2Na+2H2O=2NaOH+H2↑,
故答案为:2Na+2H2O=2NaOH+H2↑;
(6)J为C元素、R为S元素,由J、R形成的液态化合物JR2为CS2,0.2mol CS2在O2中完全燃烧,生成两种气态氧化物为二氧化碳和二氧化硫,放出热量215kJ,
1molCS2在O2中完全燃烧放热的热量为:215kJ×$\frac{1mol}{0.2mol}$=1075kJ,则该反应的热化学方程式为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1,
故答案为:CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1.
点评 本题考查了位置结构与性质的关系及其应用,题目难度中等,正确推断元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期律的关系,明确常见化学用语的书写原则,如:电子式、原子结构示意图、热化学方程式等.

| A. | 除去乙酸乙酯中的乙酸,用饱和碳酸钠水溶液洗涤后分液 | |
| B. | 用燃烧的方法可以鉴别乙醇、苯和四氯化碳 | |
| C. | 要除去甲烷中的乙烯,可选用溴水 | |
| D. | 甲烷和氯气按体积比1:3混合,可制得纯净的CHCl3 |
| A. | 醛基的结构简式-COH | B. | 聚丙烯的结构简式 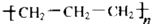 | ||
| C. | 四氯化碳分子的电子式 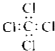 | D. | 丙烷分子的球棍模型  |
| A. | 化学变化一定伴随能量变化 | |
| B. | 化学变化一定有化学键的断裂和生成 | |
| C. | 化学变化一定放热 | |
| D. | 化学变化一定有新物质生成 |
| A. | 用食醋除去暖瓶内的水垢 | B. | 用四氯化碳擦去圆珠笔油渍 | ||
| C. | 用糯米饭、酒曲等自制甜酒酿 | D. | 用烧碱清除炊具上残留的油污 |
| A. | 亚硫酸钠 | B. | 酒精 | C. | 氢氧化钾 | D. | 氯化氢 |
| A. | 1,3-二甲基戊烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 3,4-二甲基戊烷 | D. | 2,3-二甲基戊烷 |