题目内容
14.生活中的问题常涉及化学知识,下列过程不涉及化学变化的是( )| A. | 用食醋除去暖瓶内的水垢 | B. | 用四氯化碳擦去圆珠笔油渍 | ||
| C. | 用糯米饭、酒曲等自制甜酒酿 | D. | 用烧碱清除炊具上残留的油污 |
分析 化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化与物理变化的本质区别是有无新物质生成,据此抓住化学变化和物理变化的区别结合事实进行分析判断即可.
解答 解:A用食醋除去暖瓶内的水垢有新物质生成醋酸钙,属于化学变化,故A错误;
B.用四氯化碳擦去圆珠笔油渍是利用的溶解性,没有新物质生成,属于物理变化,故B正确;
C.用糯米饭、酒曲等自制甜酒有新物质乙醇生成,属于化学变化,故C错误;
D.油污成分主要是高级脂肪酸甘油酯,在氢氧化钠溶液中水解生成甘油和高级脂肪酸钠,洗涤除去,过程中发生了化学反应,故D错误;
故选B.
点评 本题考查物理变化与化学变化的区别与联系,难度不大,解答时要分析变化过程中是否有新物质生成,这里的新物质是指和变化前的物质是不同种的物质,若没有新物质生成属于物理变化,若有新物质生成属于化学变化.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.一定温度下,反应A2(g)+B2(g)═2AB(g)达到平衡的标志是( )
| A. | 混合气体中各物质的浓度相等 | |
| B. | 单位时间内生成2nmolAB同时生成nmolB2 | |
| C. | 单位时间内生成nmolA2同时生成nmolB2 | |
| D. | 单位时间内生成nmolA2同时生成nmolAB |
5.在实验室中要使Al2(SO4)3溶液中的Al3+全部沉淀出来,最适宜的试剂是( )
| A. | NaOH溶液 | B. | Ba(OH)2溶液 | C. | 氨水 | D. | 盐酸 |
2.下列说法错误的是( )
| A. | 石油的分馏可得到汽油 | |
| B. | 石油分馏得到的重油经过催化裂化可以得到汽油 | |
| C. | 汽油是烃的混合物,煤油、柴油是由烃构成的纯净物 | |
| D. | 石油裂解是为了获得更多化工原料,如乙烯、丙烯等 |
9.J、L、R、T是原子序数依次增大的短周期主族元素,其中J、R、T在周期表中的相对位置如右表:J元素最外层电子数是电子层数的2倍.L与R同周期,且L在该周期中原子半径最大.
(1)R 2-的离子结构示意图为 .
.
(2)写出L元素与T元索组成化合物的电子式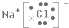 .
.
(3)写出实验室制备单质T2的离子反应方程式MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)单质T2与石灰乳反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(5)单质L与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,放出热量215kJ.则该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1.
| J | ||||
| R | T |
 .
.(2)写出L元素与T元索组成化合物的电子式
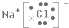 .
.(3)写出实验室制备单质T2的离子反应方程式MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)单质T2与石灰乳反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(5)单质L与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,放出热量215kJ.则该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1.
19.用粗氧化铜(含少量Fe)制取纯净的CuCl2?2H2O的主要过程是:
①将粗氧化铜溶解于稀盐酸中,加热、过滤.调节滤液的pH为3;
②对①所得的滤液按下列步骤进行操作:
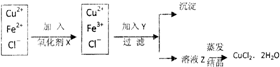
已知:
回答下列问题:
(1)加入氧化剂X的目的是:将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离
本实验最合适的氧化剂X是c(填字母)
a.K2Cr2O7 b.NaClO c.H2O2 d.KMnO4
反应的离子方程式是2H++H2O2+2Fe2+=2Fe3++2H2O.
(2)Y可选:CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3,调节pH3.2≤pH<4.7
除去Fe3+的有关离子方程式为CuO+2H+=Cu2++H2O、Fe3++3H2O=Fe(OH)3+3H+
(3)采用低温减压蒸发结晶的方法得到CuCl?2H2O的晶体,还要在过程中不断通入HCl气体,且不能蒸干.
①将粗氧化铜溶解于稀盐酸中,加热、过滤.调节滤液的pH为3;
②对①所得的滤液按下列步骤进行操作:

已知:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
(1)加入氧化剂X的目的是:将Fe2+氧化为Fe3+,便于生成沉淀而与Cu2+分离
本实验最合适的氧化剂X是c(填字母)
a.K2Cr2O7 b.NaClO c.H2O2 d.KMnO4
反应的离子方程式是2H++H2O2+2Fe2+=2Fe3++2H2O.
(2)Y可选:CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3,调节pH3.2≤pH<4.7
除去Fe3+的有关离子方程式为CuO+2H+=Cu2++H2O、Fe3++3H2O=Fe(OH)3+3H+
(3)采用低温减压蒸发结晶的方法得到CuCl?2H2O的晶体,还要在过程中不断通入HCl气体,且不能蒸干.
6.莽草酸 是从烹调香料“八角”提取的一种有机物,是合成抗禽流感药物的基本原料,1mol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为( )
是从烹调香料“八角”提取的一种有机物,是合成抗禽流感药物的基本原料,1mol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为( )
 是从烹调香料“八角”提取的一种有机物,是合成抗禽流感药物的基本原料,1mol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为( )
是从烹调香料“八角”提取的一种有机物,是合成抗禽流感药物的基本原料,1mol莽草酸与足量的Na和NaOH反应,消耗的Na和NaOH的物质的量之比为( )| A. | 4:1 | B. | 1:1 | C. | 3:1 | D. | 1:4 |
2.下列有关物质用途的说法正确的是( )
| A. | 石灰石用于燃煤烟气脱硫 | |
| B. | 二氧化硫用于漂白滋补品银耳 | |
| C. | 碳酸钠治疗胃酸过多 | |
| D. | 用FeCl2溶液与铜反应制作印刷电路板 |