题目内容
19.下列实验方法不正确的是( )| A. | 除去乙酸乙酯中的乙酸,用饱和碳酸钠水溶液洗涤后分液 | |
| B. | 用燃烧的方法可以鉴别乙醇、苯和四氯化碳 | |
| C. | 要除去甲烷中的乙烯,可选用溴水 | |
| D. | 甲烷和氯气按体积比1:3混合,可制得纯净的CHCl3 |
分析 A.乙酸乙酯不溶于饱和碳酸钠溶液,碳酸钠能够与乙酸反应;
B.四氯化碳不燃烧,根据乙醇、苯燃烧时火焰颜色不同可用鉴别;
C.甲烷不与溴水反应,乙烯能够使溴水褪色;
D.甲烷与氯气的反应中,无论氯气是否足量,生成产物都是一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳的混合物.
解答 解:A.乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,且乙酸能够与碳酸钠溶液反应,则可用用饱和碳酸钠溶液除去乙酸乙酯中的乙酸,故A正确;
B.甲醇燃烧有淡蓝色火焰,苯燃烧有黑烟,四氯化碳不燃烧,现象不同,可鉴别,故B正确;
C.乙烯能够与溴水发生加成反应,而甲烷不与溴水反应,可用溴水除去甲烷中的乙烯,故C正确;
D.甲烷和氯气按体积比1:3混合,反应生成的是一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳的混合物,无法制得纯净的CHCl3,故D错误;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及物质检验、甲烷的取代反应、物质的分离与提纯等知识,明确物质分离与提纯方法为解答关键,D为易错点,注意甲烷与氯气的反应特点,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
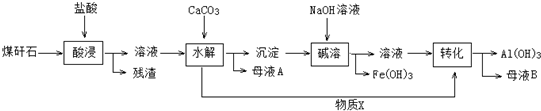
已知:
请回答下列问题:
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2,物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)酸的浓度、温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.

已知:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2,物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)酸的浓度、温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.
10. 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
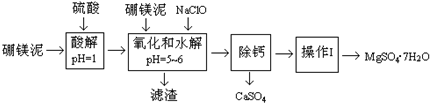
已知:NaClO与Mn2+反应产生MnO2沉淀.
根据题意回答下列问题:
(1)请提出两条加快酸解速率的措施升温、把硼镁泥粉碎、搅拌等.
(2)NaClO能将溶液中的还原性离子氧化生成沉淀,写出有关反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cll-+4H+.
(3)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是调节溶液pH,使Fe3+、Al3+水解完全,除去多余的NaClO.
(4)“除钙”MgSO4和CaSO4的混合溶液中的CaSO4除去,根据下表数据,应将混合溶液蒸发浓缩、趁热过滤;再将滤液进行“操作Ⅰ”,则析出晶体后的溶液(20℃)中c(Mg2+)=2.00mol•L-1(该溶液的密度为1.20g•cm-3).
已知MgSO4、CaSO4的溶解度如表:
(5)硫酸镁分解生成的SO2经如图的两个循环可分别得到S和H2SO4.写出循环Ⅰ中反应2的化学方程式为4ZnFeO3.5+SO2$\frac{\underline{\;△\;}}{\;}$4ZnFeO4+S;循环Ⅱ中电解过程阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+.
 硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
硼镁泥是一种工业废料,主要成份是MgO,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)请提出两条加快酸解速率的措施升温、把硼镁泥粉碎、搅拌等.
(2)NaClO能将溶液中的还原性离子氧化生成沉淀,写出有关反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cll-+4H+.
(3)除去滤渣之前,往往还要加入一定量的硼镁泥,其原因可能是调节溶液pH,使Fe3+、Al3+水解完全,除去多余的NaClO.
(4)“除钙”MgSO4和CaSO4的混合溶液中的CaSO4除去,根据下表数据,应将混合溶液蒸发浓缩、趁热过滤;再将滤液进行“操作Ⅰ”,则析出晶体后的溶液(20℃)中c(Mg2+)=2.00mol•L-1(该溶液的密度为1.20g•cm-3).
已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 20 | 40 | 50 | 60 | 70 |
| MgSO4 | 25.0 | 31.8 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.256 | 0.212 | 0.207 | 0.201 | 0.190 |
4.一定温度下,反应A2(g)+B2(g)═2AB(g)达到平衡的标志是( )
| A. | 混合气体中各物质的浓度相等 | |
| B. | 单位时间内生成2nmolAB同时生成nmolB2 | |
| C. | 单位时间内生成nmolA2同时生成nmolB2 | |
| D. | 单位时间内生成nmolA2同时生成nmolAB |
11.实验室里钠保存在下列哪种液体中( )
| A. | 煤油 | B. | 水 | C. | 苯 | D. | 四氯化碳 |
9.J、L、R、T是原子序数依次增大的短周期主族元素,其中J、R、T在周期表中的相对位置如右表:J元素最外层电子数是电子层数的2倍.L与R同周期,且L在该周期中原子半径最大.
(1)R 2-的离子结构示意图为 .
.
(2)写出L元素与T元索组成化合物的电子式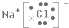 .
.
(3)写出实验室制备单质T2的离子反应方程式MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)单质T2与石灰乳反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(5)单质L与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,放出热量215kJ.则该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1.
| J | ||||
| R | T |
 .
.(2)写出L元素与T元索组成化合物的电子式
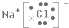 .
.(3)写出实验室制备单质T2的离子反应方程式MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)单质T2与石灰乳反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(5)单质L与水反应的化学方程式为2Na+2H2O=2NaOH+H2↑.
(6)由J、R形成的液态化合物JR20.2mol在O2中完全燃烧,生成两种气态氧化物,放出热量215kJ.则该反应的热化学方程式为CS2(l)+3O2(g)=CO2(g)+2SO2(g)△H=-1075kJ•mol-1.

 .
. ,其名称为3-乙基戊烷.
,其名称为3-乙基戊烷.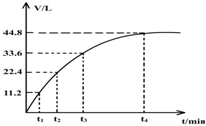 向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L.若将该混合物加入500ml15mol•L-的浓HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体.( )
向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L.若将该混合物加入500ml15mol•L-的浓HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体.( )
 ;
;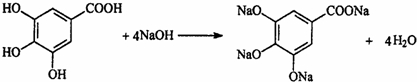 .
.