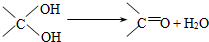
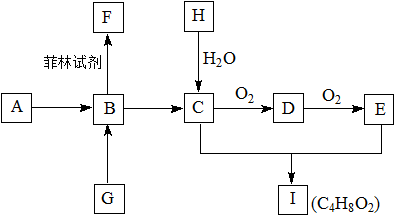
题目内容
利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体.生产过程如图:
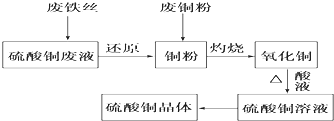
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是 ,可能发生反应的离子方程式有 .
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物.原因是
①灼烧不充分Cu未被完全氧化.
②CuO被还原.还原剂是 ,该反应的化学方程式是 .
(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h.请回答下列问题:
①反应时温度必须控制在50~60℃,温度不宜过高,这样操作的目的是 ;
②写出反应的化学方程式: .
(4)由硫酸铜溶液得到硫酸铜晶体的实验操作为 .
(5)直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是 .

试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物.原因是
①灼烧不充分Cu未被完全氧化.
②CuO被还原.还原剂是
(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h.请回答下列问题:
①反应时温度必须控制在50~60℃,温度不宜过高,这样操作的目的是
②写出反应的化学方程式:
(4)由硫酸铜溶液得到硫酸铜晶体的实验操作为
(5)直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)金属铁表面的铁锈可以和硫酸之间反应,据此回答;
(2)有机物中含有碳元素,根据有机物燃烧可以得到碳单质或是一氧化碳具有还原性,可以和氧化铜之间反应来回答;
(3)①双氧水受热易分解;
②金属铜、双氧水在酸性环境下可以发生反应,氧化铜可以和酸反应得到盐和水;
(4)硫酸铜溶液蒸发浓缩、冷却结晶可以得到硫酸铜晶体;
(5)金属铜可以和浓硫酸在加热的条件下发生反应得到硫酸铜、水以及二氧化硫.
(2)有机物中含有碳元素,根据有机物燃烧可以得到碳单质或是一氧化碳具有还原性,可以和氧化铜之间反应来回答;
(3)①双氧水受热易分解;
②金属铜、双氧水在酸性环境下可以发生反应,氧化铜可以和酸反应得到盐和水;
(4)硫酸铜溶液蒸发浓缩、冷却结晶可以得到硫酸铜晶体;
(5)金属铜可以和浓硫酸在加热的条件下发生反应得到硫酸铜、水以及二氧化硫.
解答:
解:废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体的生产流程:将金属铁投入硫酸铜中,可以置换出金属铜,金属铜可以和氧气在灼烧下发生反应生成氧化铜(废铜中含有的有机物质含有碳元素,灼烧会产生碳单质或是CO,具有还原性,可以和氧化铜在加热下发生反应,得到金属铜),氧化铜可以和硫酸反应得到硫酸铜溶液.
(1)除铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,目的是出去铁锈,发生的反应可能有:Fe2O3+6H+═2Fe3++3H2O,2Fe3++Fe═3Fe2+,Fe+2H+═Fe2++H2↑,故答案为:去铁丝表面的氧化物;Fe2O3+6H+═2Fe3++3H2O,2Fe3++Fe═3Fe2+,Fe+2H+═Fe2++H2↑;
(2)废铜中含有的有机物质含有碳元素,灼烧会产生碳单质或是CO,具有还原性,可以和氧化铜在加热下发生反应,得到金属铜,2CuO+C
2Cu+CO2↑或CuO+CO
Cu+CO2,故答案为:C或CO;2CuO+C
2Cu+CO2↑或CuO+CO
Cu+CO2;
(3)①反应时温度必须控制在50~60℃,温度不宜过高,防止双氧水分解,故答案为:防止双氧水分解;
②金属铜、双氧水在硫酸酸性环境下可以发生反应得到硫酸铜,氧化铜可以和硫酸反应得到硫酸铜溶液,即CuO+H2SO4═CuSO4+H2O,Cu+H2O2+H2SO4═CuSO4+2H2O,故答案为:CuO+H2SO4═CuSO4+H2O,Cu+H2O2+H2SO4═CuSO4+2H2O;
(4)硫酸铜溶液蒸发浓缩、冷却结晶可以得到硫酸铜晶体,故答案为:蒸发浓缩、冷却结晶;
(5)金属铜可以和浓硫酸在加热的条件下发生反应得到硫酸铜、水以及二氧化硫,①Cu+2H2SO4(浓硫酸)
CuSO4+2H2O+SO2↑,②2Cu+O2+2H2SO4
2CuSO4+2H2O,生成等量的硫酸铜晶体方法①所消耗的硫酸更多,且会产生污染大气的气体SO2,故答案为:生成等量的硫酸铜晶体所消耗的硫酸更多,且会产生污染大气的气体SO2.
(1)除铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,目的是出去铁锈,发生的反应可能有:Fe2O3+6H+═2Fe3++3H2O,2Fe3++Fe═3Fe2+,Fe+2H+═Fe2++H2↑,故答案为:去铁丝表面的氧化物;Fe2O3+6H+═2Fe3++3H2O,2Fe3++Fe═3Fe2+,Fe+2H+═Fe2++H2↑;
(2)废铜中含有的有机物质含有碳元素,灼烧会产生碳单质或是CO,具有还原性,可以和氧化铜在加热下发生反应,得到金属铜,2CuO+C
| ||
| ||
| ||
| ||
(3)①反应时温度必须控制在50~60℃,温度不宜过高,防止双氧水分解,故答案为:防止双氧水分解;
②金属铜、双氧水在硫酸酸性环境下可以发生反应得到硫酸铜,氧化铜可以和硫酸反应得到硫酸铜溶液,即CuO+H2SO4═CuSO4+H2O,Cu+H2O2+H2SO4═CuSO4+2H2O,故答案为:CuO+H2SO4═CuSO4+H2O,Cu+H2O2+H2SO4═CuSO4+2H2O;
(4)硫酸铜溶液蒸发浓缩、冷却结晶可以得到硫酸铜晶体,故答案为:蒸发浓缩、冷却结晶;
(5)金属铜可以和浓硫酸在加热的条件下发生反应得到硫酸铜、水以及二氧化硫,①Cu+2H2SO4(浓硫酸)
| ||
| ||
点评:本题是一道物质的分离和提纯的实验方案设计题,考查学生分析和解决问题的能力,难度中等.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、22.4 L O2中含有氧分子的个数为2NA |
| B、24g Mg与足量氧气反应转移的电子数为2NA |
| C、28g N2中含有氮原子的个数为NA |
| D、1L 1 mol?L-1MgCl2溶液中含有氯离子个数为NA |
下列粒子的结构示意图中,表示氯离子的是( )
A、 |
B、 |
C、 |
D、 |
X、Y、Z三种短周期非金属元素在元素周期表中的位置如图所示,下列说法正确的是( )
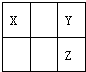

| A、原子的半径:Y大于X |
| B、氢化物的稳定性:X大于Y |
| C、最高价氧化物水化物的酸性:Z强于Y |
| D、Z原子比Y原子多一个电子层 |