题目内容
12.X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )| A. | 原子最外层电子数:X>Y>Z | B. | 原子半径:X>Y>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
分析 X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素,结合元素在周期表中的位置以及元素周期律知识解答该题.
解答 解:X、Z的最低价离子分别为X2-和Z-,则X为第ⅥA族元素,Z为ⅦA族元素;Y+和Z-具有相同的电子层结构,则Y在Z的下一周期,则Y为Na元素,Z为F元素,X、Y同周期,则X为S元素,
A.X、Y、Z分别为S、Na、F,原子最外层电子数分别为6、1、7,即原子最外层电子数:Z>X>Y,故A错误;
B.电子层数越大原子半径越大,电子层数相同,原子序数越大半径越小,则原子半径:Y>X>Z,故B错误;
C.Na+、F-具有相同的核外电子排布,离子的核电荷数越大,半径越小,应为F->Na+,S2-电子层最多,离子半径最大,故离子半径S2->F->Na+,故C错误;
D.X、Y、Z的原子序数分别为16、11、9,则原子序数:X>Y>Z,故D正确.
故选D.
点评 本题考查原子结构与元素周期律的关系,侧重于学生的分析能力的考查,题目难度不大,本题的关键是根据原子结构特点正确推断元素的种类.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.下列物质中所含分子数最多的是( )
| A. | 56gN2 | B. | 3.01×1023个硫酸分子 | ||
| C. | 标准状况下22.4L Cl2 | D. | 1.5molO2 |
20.在一个恒容绝热的密闭容器中,发生可逆反应:M(?)+2N(g)?P(g)+Q(g) 该反应为吸热反应,已知M的状态未知,则下列描述一定达到平衡的标志是( )
①当物质M、N、P的体积分数比为 1:1:1时 ②混合气体的密度不变时
③体系的温度不变时 ④反应速率2v (N)正=v (Q)逆时
⑤体系的压强不变时 ⑥气体的平均相对分子质量不变时.
①当物质M、N、P的体积分数比为 1:1:1时 ②混合气体的密度不变时
③体系的温度不变时 ④反应速率2v (N)正=v (Q)逆时
⑤体系的压强不变时 ⑥气体的平均相对分子质量不变时.
| A. | ①③④ | B. | ③⑤⑥ | C. | ②③⑥ | D. | ③④⑤ |
7.某有机物的结构简式为 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 该有机物属于饱和烷烃 | |
| B. | 该烃与2,5-二甲基-3-乙基己烷互为同系物 | |
| C. | 该烃的名称是3-甲基-5-乙基庚烷 | |
| D. | 该烃的一氯取代产物共有8种 |
17.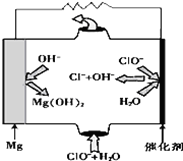 镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
 镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 该电池的总反应为:Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| C. | 电池工作时,正极周围溶液的碱性将不断减弱 | |
| D. | 电池工作时,OH-向正极移动 |
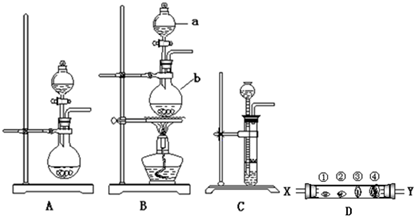
4.下列有关物质的分离或提纯的说法中正确的是( )
| A. | 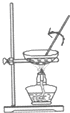 图:从FeCl2溶液中制取FeCl2晶体 | |
| B. | 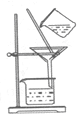 图:从制取Fe(OH)2胶体的混合物中提纯胶体 | |
| C. | 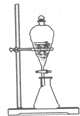 图:用CCl4萃取,从溴水中得到纯溴 | |
| D. | 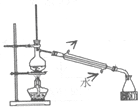 图:分离苯和甲苯 |
1.乙醇分子结构中各化学键如图所示.关于乙醇在各种反应中断键说法不正确的是( )
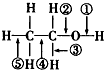
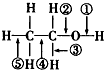
| A. | 在银催化条件下与O2反应时断裂①和③ | |
| B. | 乙醇燃烧是断裂②和⑤ | |
| C. | 和金属钠反应时①断裂 | |
| D. | 和浓H2SO4、乙酸共热时断裂①,其他键不变化 |
2.透明强酸性溶液中,下列各组离子一定能大量共存的是( )
| A. | Cl-、Cu2+、SO42-、NO3- | B. | Cl-、Na+、SO42-、CH3COO- | ||
| C. | Cl-、Fe2+、MnO4-、NO3- | D. | AlO2-、Na+、SO42-、NO3- |