题目内容
13.某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢.该物质可发生如下转化,其中D1、D2互为同分异构体,E1、E2互为同分异构体.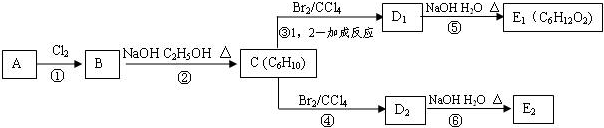
(1)A的名称为:2,3-二甲基-2-丁烯 C的结构简式为:
 ;E2含有的含氧官能团的名称为:羟基.
;E2含有的含氧官能团的名称为:羟基.(2)反应②的化学方程式为:
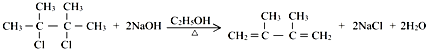 ,反应类型为:消去反应;反应⑥的化学方程式为:
,反应类型为:消去反应;反应⑥的化学方程式为: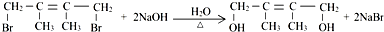 ,反应类型为:水解反应(或取代反应).
,反应类型为:水解反应(或取代反应).(3)与A的分子式相同的烯烃,除A外还有12种不同的结构;写出其中主链为4个碳,分子中有三种不同类型的氢原子,且与A同类的所有物质的结构简式:
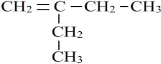 、
、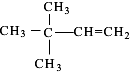 (均不考虑立体异构).
(均不考虑立体异构).
分析 某烃类化合物A的质谱图表明其相对分子质量为84,令组成为CxHy,则x最大值为$\frac{84}{12}$=7,红外光谱表明分子中含有碳碳双键,所以A为烯烃,所以x=6,y=12,因此A的化学式为C6H12,核磁共振氢谱表明分子中只有一种类型的氢,故A的结构简式为: ,则B为
,则B为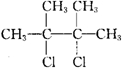 ,在乙醇的碱性溶液中加热时发生消去反应,生成的C为
,在乙醇的碱性溶液中加热时发生消去反应,生成的C为 ,C发生1,2-加成生成D1,则D1为
,C发生1,2-加成生成D1,则D1为 ,D1在氢氧化钠水溶液中发生水解反应生成E1,则E1为
,D1在氢氧化钠水溶液中发生水解反应生成E1,则E1为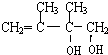 ,D1、D2互为同分异构体,故反应④发生1,4-加成,则D2为
,D1、D2互为同分异构体,故反应④发生1,4-加成,则D2为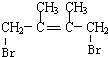 ,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为
,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为 ,以此解答该题.
,以此解答该题.
解答 解:某烃类化合物A的质谱图表明其相对分子质量为84,令组成为CxHy,则x最大值为$\frac{84}{12}$=7,红外光谱表明分子中含有碳碳双键,所以A为烯烃,所以x=6,y=12,因此A的化学式为C6H12,核磁共振氢谱表明分子中只有一种类型的氢,故A的结构简式为: ,则B为
,则B为 ,在乙醇的碱性溶液中加热时发生消去反应,生成的C为
,在乙醇的碱性溶液中加热时发生消去反应,生成的C为 ,C发生1,2-加成生成D1,则D1为
,C发生1,2-加成生成D1,则D1为 ,D1在氢氧化钠水溶液中发生水解反应生成E1,则E1为
,D1在氢氧化钠水溶液中发生水解反应生成E1,则E1为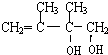 ,D1、D2互为同分异构体,故反应④发生1,4-加成,则D2为
,D1、D2互为同分异构体,故反应④发生1,4-加成,则D2为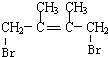 ,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为
,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为 ,
,
(1)由上述分析可知,A的结构简式为: ,名称为2,3-二甲基-2-丁烯,C为
,名称为2,3-二甲基-2-丁烯,C为 ,E2为
,E2为 ,含氧官能团为羟基,
,含氧官能团为羟基,
故答案为:2,3-二甲基-2-丁烯; ;羟基;
;羟基;
(2)反应②的化学方程式为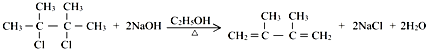 ,为消去反应,反应⑥的化学方程式为
,为消去反应,反应⑥的化学方程式为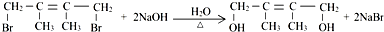 ,为水解反应(或取代反应),
,为水解反应(或取代反应),
故答案为: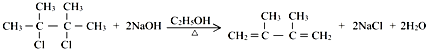 ;消去反应;
;消去反应;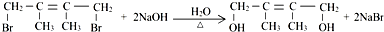 ;水解反应(或取代反应);
;水解反应(或取代反应);
(3)分子式为C6H12且属于烯烃的同分异构体有: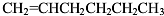 、
、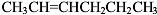 、
、 、
、 、
、 、
、 、
、 、
、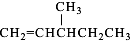 、
、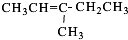 、
、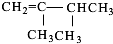 、
、 、
、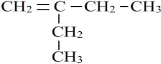 、
、 ,共13种,其中主链为4个碳,分子中有三种不同类型的氢原子,且与A同类的所有物质的结构简式有
,共13种,其中主链为4个碳,分子中有三种不同类型的氢原子,且与A同类的所有物质的结构简式有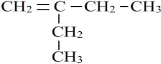 、
、 ,
,
故答案为:12;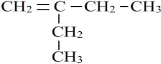 、
、 .
.
点评 本题考查有机物推断,为高考常见题型,侧重于学生的分析能力的考查,题目涉及卤代烃、烯、醇等的性质以及分子式的求解、同分异构体、有机化学反应类型和方程式的书写等,题目综合性较大,注意二烯烃的加成反应,难度中等.

| A. |  图:从FeCl2溶液中制取FeCl2晶体 | |
| B. | 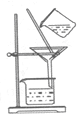 图:从制取Fe(OH)2胶体的混合物中提纯胶体 | |
| C. | 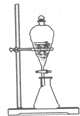 图:用CCl4萃取,从溴水中得到纯溴 | |
| D. | 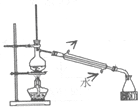 图:分离苯和甲苯 |
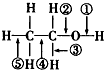
| A. | 在银催化条件下与O2反应时断裂①和③ | |
| B. | 乙醇燃烧是断裂②和⑤ | |
| C. | 和金属钠反应时①断裂 | |
| D. | 和浓H2SO4、乙酸共热时断裂①,其他键不变化 |
| A. | 实验室制取乙酸乙酯的方程式为:CH3COOH+H18O-C2H5$?_{△}^{浓H_{2}SO_{4}}$CH3COOC2H5+H${\;}_{2}^{\;}$18O | |
| B. | 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+ | |
| C. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 | |
| D. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变 |
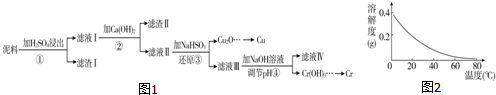
已知:部分物质沉淀的pH如表:
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
请回答下列问题:
(1)滤液Ⅰ中所含溶质主要有Fe2(SO4)3、Cr2(SO4)3、CuSO4(填化学式).
(2)第②步操作中,先加入Ca(OH)2调节溶液的pH,调节范围为3.2≤pH<4.3,然后将浊液加热至80℃趁热过滤,所得滤渣Ⅱ的成分为Fe(OH)3、CaSO4.
(3)第③步操作中,发现除了生成砖红色沉淀外,还产生了无色刺激性气味的气体.写出该步骤中发生反应的离子方程式2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+、HSO3-+H+=SO2↑+H2O.
(4)当离子浓度≤1×10-5 mol•L-1时,可以认为离子沉淀完全.第④步操作中,若要使Cr3+完全沉淀,则室温下溶液中a的最小值为5.6.已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{64}$≈4.0;lg 4=0.6.
(5)Cr(OH)3受热分解为Cr2O3,用铝热法可以冶炼金属铬.写出铝热法炼铬的化学方程式Cr2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Cr.
| A. | 用洁净铂丝蘸取未知溶液进行焰色反应,呈黄色火焰,则该溶液有Na+,但不能确定K+的存在 | |
| B. | 实验室制取乙酸乙酯时,向试管中加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸 | |
| C. | 用已知浓度NaOH溶液滴定未知浓度盐酸,滴定终点时,俯视刻度线,则测得盐酸浓度偏小 | |
| D. | 相同温度下,可以通过观察气泡多少来比较不同浓度Na2SO3溶液与稀H2SO4溶液反应的快慢 |
| A. | Cl-、Cu2+、SO42-、NO3- | B. | Cl-、Na+、SO42-、CH3COO- | ||
| C. | Cl-、Fe2+、MnO4-、NO3- | D. | AlO2-、Na+、SO42-、NO3- |
| A. | 1 mol氢约含有阿伏伽德罗常数个氢 | |
| B. | 1 molCaCl2含有2 mol Cl- | |
| C. | 1 mol氢气含有6.02×1023个电子 | |
| D. | 1 molH2O含有1 molH2和1 molO |