题目内容
10.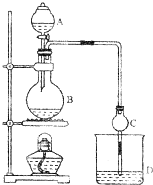 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、乙酸,D中放有饱和碳酸钠溶液.请回答:
(1)浓硫酸的作用是作催化剂、吸水剂;该反应的化学方程式:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)球形干燥管C的作用是防止倒吸、冷凝.
(3)D中饱和碳酸钠溶液的作用有ABC(填序号)
A、溶解乙醇 B、吸收乙酸 C、减小乙酸乙酯的溶解度.
分析 (1)根据乙酸与乙醇在加热、浓硫酸作催化剂的条件下发生酯化反应生成乙酸乙酯,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(2)球形干燥管的管口伸入液面下可以防止倒吸,同时起冷凝的作用;
便于分层得到酯,故D中的溶液为饱和的碳酸钠溶液,碳酸根是弱酸的酸根离子能水解,溶液呈碱性,反应后溶液分层,上层无色油体液体,由于碳酸钠与乙酸反应,故下层溶液颜色变;
(3)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,反应掉挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯.
解答 解:(1)乙酸与乙醇在加热、浓硫酸作催化剂的条件下发生酯化反应生成乙酸乙酯,该反应为可逆反应,方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,则浓硫酸的作用为催化剂、吸水剂;
故答案为:催化剂、吸水剂;CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)球形干燥管的管口伸入液面下可以防止倒吸,同时起冷凝的作用;
故答案为:防止倒吸、冷凝;
(3)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,反应掉挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:ABC.
点评 本题考查乙酸乙酯的制备,难度中等,注意掌握乙酸乙酯的制取原理及装置选择,明确反应过程中浓硫酸、饱和碳酸钠溶液的作用.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
18.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)C元素在元素周期表中的位置是第三周期第Ш A族;
(2)B的原子结构示意图为 ;
;
(3)D、E气态氢化物的稳定性强弱顺序为H2S<HCl(填化学式);
(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(5)以C为材料制成的容器不能贮存强碱溶液,用离子方程式表示其原因为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号.推测碲元素在周期表中的位置,则碲元素及其化合物可能具有的性质为:ACD;
A.单质碲在常温下是固体 B.Cl2通入H2Te溶液中不发生反应
C.H2Te不如HI稳定 D.H2TeO4的酸性比H2SO4的弱
(7)液态GA3的电离方式与液态A2F类似,则液态GA3的电离方程式为2NH3(l) NH4++NH2-.
NH4++NH2-.
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
(2)B的原子结构示意图为
 ;
;(3)D、E气态氢化物的稳定性强弱顺序为H2S<HCl(填化学式);
(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(5)以C为材料制成的容器不能贮存强碱溶液,用离子方程式表示其原因为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号.推测碲元素在周期表中的位置,则碲元素及其化合物可能具有的性质为:ACD;
A.单质碲在常温下是固体 B.Cl2通入H2Te溶液中不发生反应
C.H2Te不如HI稳定 D.H2TeO4的酸性比H2SO4的弱
(7)液态GA3的电离方式与液态A2F类似,则液态GA3的电离方程式为2NH3(l)
 NH4++NH2-.
NH4++NH2-.
5.CoCl2•6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:
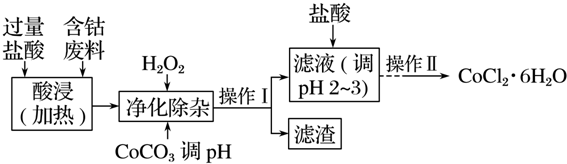
已知:
(1)净化除杂质时,加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为Fe(OH)3、Al(OH)3.
(3)加盐酸调整pH为2~3的目的为抑制CoCl2水解.
(4)操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤、洗涤、干燥.其中洗涤的操作为在过滤器中加入蒸馏水使水没过晶体,静置,使其自然流下,重复2-3次.

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
(2)加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为Fe(OH)3、Al(OH)3.
(3)加盐酸调整pH为2~3的目的为抑制CoCl2水解.
(4)操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤、洗涤、干燥.其中洗涤的操作为在过滤器中加入蒸馏水使水没过晶体,静置,使其自然流下,重复2-3次.
15.目前,安全生产和食品、药品安全受到人们的高度重视.下列有关说法不正确的是( )
| A. | 检查病人胃病所用的钡餐,只能用BaSO4,不可以用BaCO3 | |
| B. | 为了使馒头、银耳等洁白、卖相好,可以用点燃硫磺法熏蒸它们 | |
| C. | 可以用SO2来漂白纸浆、毛、丝、草帽辫等 | |
| D. | “硫磺”温泉可以医治皮肤病 |
2.体积为V mL、密度为ρg/cm3的溶液中,含相对分子质量为M的溶质m g,物质的量浓度为c mol/L,溶质质量分数为W%.下列表示式中正确的是( )
| A. | c=$\frac{m}{VM}$ | B. | m=ρVM | C. | W%=$\frac{cM}{1000p}$% | D. | c=$\frac{1000ρW%}{M}$ |
19.如果要除去粗盐中含有的可溶性杂质氯化钙、氯化镁和一些硫酸钠,按下表所示顺序,应加入什么试剂?完成下列表格:
| 杂质 | 加入试剂 | 化学方程式 |
| 硫酸盐 | ||
| MgCl2 | ||
| CaCl2 |
20.氰(CN)2与氯气的性质相似,下表所示是氰与氯气的部分性质.( )
| 物质 | 熔点/℃ | 沸点/℃ | 水溶性 |
| (CN)2 | -34 | -21.2 | 可溶 |
| Cl2 | -101 | -34 | 可溶 |
| A. | 二者均为非金属单质 | |
| B. | 标况下,氰的体积大于氯气的体积 | |
| C. | 同温同压下,相同质量的氰和氯气,前者含有的原子多 | |
| D. | 标况下,氰与氯气的密度之比为71:52 |
 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.