题目内容
8.为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2,CO2,SO2,NO,CO,不考虑其他成分),设计了如下流程: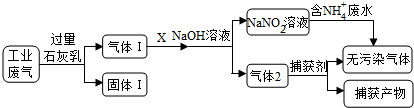
下列说法不正确的是( )
| A. | 固体Ⅰ中主要含有Ca(OH)2、CaCO3、CaSO3 | |
| B. | X可以是空气,且需过量 | |
| C. | 捕获剂所捕获的气体主要是CO | |
| D. | 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-=N2↑+2H2O |
分析 工业废气中CO2、SO2可被石灰水吸收,生成固体1为CaCO3、CaSO3,气体1是不能被过量石灰水吸收的N2、NO、CO,气体1通入气体X,用氢氧化钠溶液处理后到的NaNO2,X可为空气,但不能过量,否则得到硝酸钠,NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,则气体2含有CO、N2,捕获剂所捕获的气体主要是CO,以此解答该题.
解答 解:工业废气中CO2、SO2可被石灰水吸收,生成固体1为CaCO3、CaSO3,气体1是不能被过量石灰水吸收的N2、NO、CO,气体1通入气体X,用氢氧化钠溶液处理后到的NaNO2,X可为空气,但不能过量,否则得到硝酸钠,NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,则气体2含有CO、N2,捕获剂所捕获的气体主要是CO,
A.工业废气中CO2、SO2可被石灰水吸收,生成CaCO3、CaSO3,因氢氧化钙过量,则固体1为主要含有Ca(OH)2、CaCO3、CaSO3,故A正确;
B.由分析可知,气体1是不能被过量石灰水吸收的N2、NO、CO,气体1通入气体X,用氢氧化钠溶液处理后到的NaNO2,X可为空气,但不能过量,否则得到硝酸钠,故B错误;
C.气体2含有CO、N2,经捕获剂得到氮气和CO,所捕获的气体主要是CO,防止污染空气,故C正确;
D.NaNO2与含有NH4+的溶液反应生成无污染气体,应生成氮气,发生氧化还原反应,离子方程式为NH4++NO2-=N2↑+2H2O,故D正确.
故选B.
点评 本题考查物质的分离、提纯的综合引用,侧重学生的分析、实验能力的考查,注意把握物质的性质,为解答该题的关系,题目涉及废水的处理,有利于培养学生良好的科学素养,提高环保意识,难度不大.

练习册系列答案
相关题目
19.X、Y、Z、W均为短周期主族元素,X与W、Y与Z分别位于同一周期,X、Y、Z的最外层电子数依次增大,W的最外层电子数是X与Y的最外层电子数之和,Z的最简单氢化物为甲,W的最简单氢化物为乙,乙是双原子分子且甲、乙混合时有白烟生成,下列说法正确的是( )
| A. | 原子半径:X>W>Z>Y | |
| B. | 化合物ZW3溶于水时水解生成一种弱碱和一种强酸 | |
| C. | X的最高价氧化物能与Z的最高价氧化物对应的水化物反应 | |
| D. | 甲、乙混合时生成的白烟为离子化合物,且该化合物只含有离子键 |
16.在可逆反应mX+nY?pZ+qW中,在反应开始后的10s,若用每种物质的浓度增加表示该段时间的平均反应速率时分别为v(X=0.5amol•L-1•s-1,v(Y)=0.25amol•L-1•s-1,v(Z)=amol•L-1•s-1,v(W)=1.5amol•L-1•s-1.若用每种物质的浓度减少表示该段时间的平均反应速率时分别为v(X)=amol•L-1•s-1,v(Y)=0.5amol•L-1•s-1,v(Z)=0.5amol•L-1•s-1,v(W)=0.75amol•L-1•s-1,则m:n:p:q为( )
| A. | 2:1:2:3 | B. | 2:1:4:6 | C. | 2:1:4:3 | D. | 1:1:1:1 |
3. 已知t℃时,AgCl的Ksp=2×10-10,Ag2CrO4(橙红色固体)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
已知t℃时,AgCl的Ksp=2×10-10,Ag2CrO4(橙红色固体)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
 已知t℃时,AgCl的Ksp=2×10-10,Ag2CrO4(橙红色固体)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
已知t℃时,AgCl的Ksp=2×10-10,Ag2CrO4(橙红色固体)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )| A. | t℃时,AgCl在水中的溶解度比在稀盐酸中小 | |
| B. | t℃时,AgCl的溶解度大于Ag2CrO4 | |
| C. | 在饱和Ag2CrO4溶液中加入少量K2CrO4,可使溶液由Y点移至X点 | |
| D. | 向同浓度NaCl和K2CrO4混合液中,滴加0.1mol•L-1AgNO3溶液,先生成白色沉淀 |
13.一定温度下,在3个体积均为1.0L的容量密闭容器中反应2H2(g)+CO(g)?CH3OH(g) 达到平衡,下列说法正确的是( )
| 容器 | 温度/℃ | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应放热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
20.关于由铜、锌和稀硫酸组成的原电池中,下列各叙述正确的是( )
| A. | 负极附近c(Zn2+)减小 | |
| B. | 溶液的pH变小 | |
| C. | H+向负极移动 | |
| D. | 若Cu,Zn两极上同时有气泡逸出,则说明Zn片不纯 |
17.下列化工生产过程中,未涉及氧化还原反应的是( )
| A. | 海带提碘 | B. | 氯碱工业 | C. | 氨碱法制碱 | D. | 海水提溴 |
 A、B、C三种固体物质的溶解度曲线如图所示.
A、B、C三种固体物质的溶解度曲线如图所示.