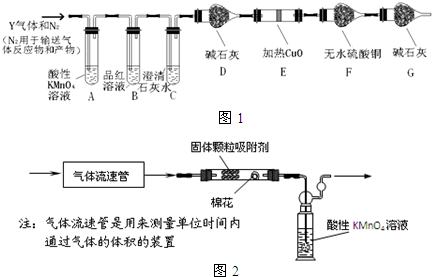
题目内容
3. 已知t℃时,AgCl的Ksp=2×10-10,Ag2CrO4(橙红色固体)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
已知t℃时,AgCl的Ksp=2×10-10,Ag2CrO4(橙红色固体)在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )| A. | t℃时,AgCl在水中的溶解度比在稀盐酸中小 | |
| B. | t℃时,AgCl的溶解度大于Ag2CrO4 | |
| C. | 在饱和Ag2CrO4溶液中加入少量K2CrO4,可使溶液由Y点移至X点 | |
| D. | 向同浓度NaCl和K2CrO4混合液中,滴加0.1mol•L-1AgNO3溶液,先生成白色沉淀 |
分析 A.AgCl在水溶液中存在溶解平衡,氯离子浓度越大,AgCl的溶解度越小;
B.已知t℃时AgCl的Ksp=2×10-10,由图象可知Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,则s(AgCl)=$\sqrt{{K}_{SP}}=\sqrt{2×1{0}^{-10}}$=1.41×10-5,而s(Ag2CrO4)=$\root{3}{\frac{{K}_{SP}}{4}}=\frac{\root{3}{2}}{2}$×10-4;
C.在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上;
D.依据溶液中离子浓度结合溶度积常数计算银离子浓度,银离子浓度越小先析出沉淀.
解答 解:A.AgCl在水溶液中存在溶解平衡,氯离子浓度越大,AgCl的溶解度越小,则AgCl在水中的溶解度较大,故A错误;
B.已知t℃时AgCl的Ksp=2×10-10,由图象可知Ksp=c2(Ag+)c(CrO42-)=(10-3)2×10-6=10-12,则s(AgCl)=$\sqrt{{K}_{SP}}=\sqrt{2×1{0}^{-10}}$=1.41×10-5,而s(Ag2CrO4)=$\root{3}{\frac{{K}_{SP}}{4}}=\frac{\root{3}{2}}{2}$×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,故B错误;
C.在饱和Ag2CrO4溶液中加入K2CrO4仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点,故C错误;
D.依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=2.0×10-10,以0.1mol/L AgNO3溶液滴定同浓度的KCl和K2CrO4的混合溶液,设浓度为0.1mol/L,则生成Ag2CrO4沉淀时c(Ag+)=$\sqrt{\frac{1{0}^{-12}}{0.1}}$mol/L,0.1mol/L KCl溶液中,c(Cl-)=0.1mol/L;依据溶度积计算得到:c(Ag+)=$\frac{2×1{0}^{-10}}{0.1}$=2×10-9mol/L,所以先析出氯化银沉淀,故D正确.
故选D.
点评 本题考查了沉淀溶解平衡的分析判断、溶度积常数的计算应用等,为高频考点和常见题型,侧重于考查学生的分析能力和计算能力,注意把握相关计算公式的运用,理解图象的含义,题目难度中等.

| 目的 | 古代文献 | 说明 | |
| A | 使用 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”-《天工开物》 | KNO3能自燃 |
| B | 性质 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧餇诸药者”-《本草纲目》 | 利用KNO3的氧化性 |
| C | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”-《本草经集注》 | 利用焰色反应 |
| D | 提纯 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”-《开宝本草》 | 溶解、蒸发、结晶 |
| A. | A | B. | B | C. | C | D. | D |
| 选项 | 试剂甲 | 试剂乙 | 实验目的 | 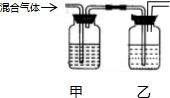 |
| A | NaOH溶液 | 浓硫酸 | 从等体积NO、NH3和NO2中分离出NO | |
| B | KMnO4溶液 | 浓硫酸 | 除去Cl2中的SO2、HCl得干燥Cl2 | |
| C | 溴水 | 浓H2SO4 | 除去乙炔中的H2S和H2O(g) | |
| D | 品红溶液 | 石灰水 | 检验混合气体HCl、SO2、CO2中的SO2和CO2 |
| A. | A | B. | B | C. | C | D. | D |
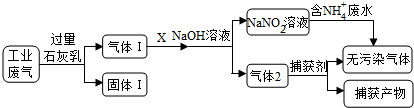
下列说法不正确的是( )
| A. | 固体Ⅰ中主要含有Ca(OH)2、CaCO3、CaSO3 | |
| B. | X可以是空气,且需过量 | |
| C. | 捕获剂所捕获的气体主要是CO | |
| D. | 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-=N2↑+2H2O |
| A. | 水是无机物,故有机物在水中的溶解度都很小 | |
| B. | 氢键对物质的溶解性没有影响 | |
| C. | 溶质能与水发生化学反应将增大其在水中的溶解度 | |
| D. | CO与水都是极性分子,故CO易溶于水 |
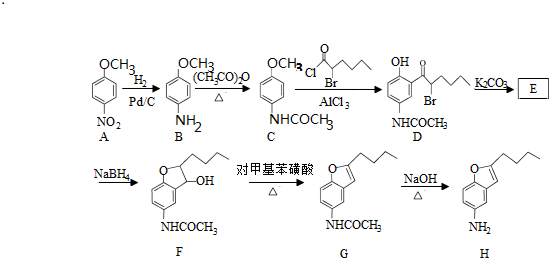
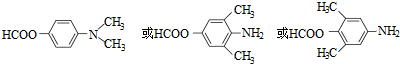 .
.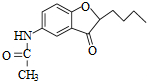 .
.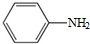 )易被氧化
)易被氧化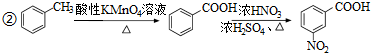
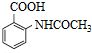 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).