题目内容
碱式硫酸铁Fe(OH)SO4对水中的悬浮物、有机物、硫化物、重金属等都能絮凝,工业上常用硫酸亚铁法制备,工艺流程如图所示:
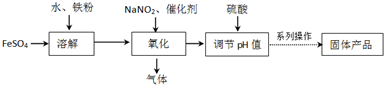
已知:Fe3+沉淀完全时的pH=3.1,Fe2+沉淀完全时的pH=9.7
(1)请写出溶解过程中加快溶解速率和提高浸出率的两点措施: , .
(2)加入硫酸的作用是控制体系的pH值,若硫酸加入量过小,反应体系酸度太低,容易生成 沉淀;若硫酸加入量过大,不利于产品形成,试从平衡移动的角度分析原因是 .
(3)氧化过程中生成的气体遇空气变红棕色.写出氧化过程发生的离子方程式: .
(4)流程图中的“系列操作”包括 , ,过滤,洗涤,烘干.

已知:Fe3+沉淀完全时的pH=3.1,Fe2+沉淀完全时的pH=9.7
(1)请写出溶解过程中加快溶解速率和提高浸出率的两点措施:
(2)加入硫酸的作用是控制体系的pH值,若硫酸加入量过小,反应体系酸度太低,容易生成
(3)氧化过程中生成的气体遇空气变红棕色.写出氧化过程发生的离子方程式:
(4)流程图中的“系列操作”包括
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)升高温度能提高物质的溶解性和加速溶解,搅拌可加速物质的溶解;
(2)Fe3+沉淀完全时的pH=3.1,若酸度太低,碱性增强,易生成氢氧化铁沉淀;若加入硫酸过大,氢离子浓度增大,会中和Fe(OH)SO4中的氢氧根离子,不利于碱式硫酸铁的生成;
(3)氧化过程中生成的气体遇空气变红棕色,说明亚硝酸钠被还原为NO气体,亚硝酸钠在酸溶液中氧化亚铁离子为铁离子,依据氧化还原反应电子守恒和电荷守恒,原子守恒配平写出方程式;
(4)从溶液中获得晶体需要经过蒸发浓缩、冷却结晶.
(2)Fe3+沉淀完全时的pH=3.1,若酸度太低,碱性增强,易生成氢氧化铁沉淀;若加入硫酸过大,氢离子浓度增大,会中和Fe(OH)SO4中的氢氧根离子,不利于碱式硫酸铁的生成;
(3)氧化过程中生成的气体遇空气变红棕色,说明亚硝酸钠被还原为NO气体,亚硝酸钠在酸溶液中氧化亚铁离子为铁离子,依据氧化还原反应电子守恒和电荷守恒,原子守恒配平写出方程式;
(4)从溶液中获得晶体需要经过蒸发浓缩、冷却结晶.
解答:
解:(1)可通过升高温度提高硫酸亚铁的溶解度,或通过搅拌加速溶解,延长溶解时间使更多硫酸亚铁溶解;
故答案为:适当升温、充分搅拌;延长溶解时间;
(2)Fe3+沉淀完全时的pH=3.1,若酸度太低,碱性增强,易生成氢氧化铁沉淀;若加入硫酸过大,氢离子浓度增大,会中和Fe(OH)SO4电离的氢氧根离子,
Fe(OH)SO4?Fe2++2OH-+SO42-,使电离平衡向右移动,不利于碱式硫酸铁的生成;
故答案为:Fe(OH)3沉淀;过量的硫酸与Fe(OH)SO4电离出来的OH-中和,使电离平衡向右移动;
(3)亚硝酸根在酸溶液中氧化亚铁离子为铁离子,本身被还原为NO气体,依据氧化还原反应电子守恒和电荷守恒,原子守恒写出反应的离子方程式为:
Fe2++NO2-+SO42-+H+=Fe(OH)SO4+NO↑;
故答案为:Fe2++NO2-+SO42-+H+=Fe(OH)SO4+NO↑;
(4)母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到碱式硫酸铁;
故答案为:蒸发浓缩;冷却结晶.
故答案为:适当升温、充分搅拌;延长溶解时间;
(2)Fe3+沉淀完全时的pH=3.1,若酸度太低,碱性增强,易生成氢氧化铁沉淀;若加入硫酸过大,氢离子浓度增大,会中和Fe(OH)SO4电离的氢氧根离子,
Fe(OH)SO4?Fe2++2OH-+SO42-,使电离平衡向右移动,不利于碱式硫酸铁的生成;
故答案为:Fe(OH)3沉淀;过量的硫酸与Fe(OH)SO4电离出来的OH-中和,使电离平衡向右移动;
(3)亚硝酸根在酸溶液中氧化亚铁离子为铁离子,本身被还原为NO气体,依据氧化还原反应电子守恒和电荷守恒,原子守恒写出反应的离子方程式为:
Fe2++NO2-+SO42-+H+=Fe(OH)SO4+NO↑;
故答案为:Fe2++NO2-+SO42-+H+=Fe(OH)SO4+NO↑;
(4)母液经蒸发浓缩至溶液表面刚出现薄层的结晶为止,冷却结晶,得到碱式硫酸铁;
故答案为:蒸发浓缩;冷却结晶.
点评:本题考查工艺流程、对条件的控制选择、物质的分离提纯等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.

练习册系列答案
相关题目
当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A、CaCl2溶液 |
| B、CuSO4溶液 |
| C、Fe(OH)3胶体 |
| D、稀H2SO4 |
下列实验操作正确的是( )
| A、粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌漏斗中的液体 |
| B、分液操作中,将下层液体放入一烧杯后,再将上层液体继续放入另一烧杯中 |
| C、蒸发KNO3溶液时,当蒸发皿中出现大量晶体时即停止加热,用余热蒸干剩余的水分,获取KNO3晶体 |
| D、蒸馏操作中,温度计水银球部位要插入液面下且不接触蒸馏烧瓶壁 |
下列分离和提纯的实验操作中,正确的是( )


| A、蒸发 | B、过滤 | C、蒸馏 | D、分液 |
重水(2H2O)是重要的核工业原料,下列说法不正确的是( )
A、氘(
| ||||
B、
| ||||
| C、1H2O与2H2O是同一种物质 | ||||
| D、1H218O与2H216O的相对分子质量相同 |
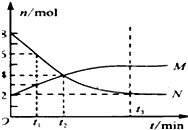 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:N?2M |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、平衡时,N的转化率是75% |
| D、t1分钟内,反应速率:v(M)=2v(N) |