题目内容
18.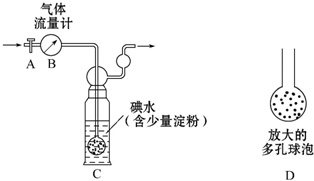 硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某化学研究性学习小组的同学欲采用以下方案测定硫酸工业尾气中SO2含量
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某化学研究性学习小组的同学欲采用以下方案测定硫酸工业尾气中SO2含量方案甲:如图所示,图中气体流量计B用于准确测量通过尾气的体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
(1)洗气瓶C中发生反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI;
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是增大SO2与碘水的接触面积,使SO2和碘水充分反应;
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量偏低(填“偏高”“偏低”或“无影响”);
(4)下列溶液中,可以用来替代洗气瓶C中的溶液的是BC(选填字母编号)
A.NaOH溶液 B.品红试剂 C.酸性高锰酸钾溶液 D.Na2CO3溶液.
分析 甲方案利用的原理为:SO2+I2+2H2O=H2SO4+2HI,据此确定二氧化硫的物质的量,进而定尾气中二氧化硫的含量;
(1)洗气瓶C中发生反应是二氧化硫和碘单质发生氧化还原反应生成硫酸和碘化氢;
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大;
(4)洗气瓶C中的溶液还可以用酸性高锰酸钾溶液、溴水等代替,试剂需要能够指示反应完全.
解答 解:甲方案利用的原理为:SO2+I2+2H2O=H2SO4+2HI,最后测定剩余气体的体积,进而定尾气中二氧化硫的含量;
(1)洗气瓶C中发生反应是二氧化硫和碘单质发生氧化还原反应生成硫酸和碘化氢,反应的化学方程式为:SO2+I2+2H2O=H2SO4+2HI,
故答案为;SO2+I2+2H2O=H2SO4+2HI;
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以增大SO2与碘水的接触面积,使SO2和碘水充分反应;
故答案为:增大SO2与碘水的接触面积,使SO2和碘水充分反应;
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,则通入尾气的体积增大,因此SO2含量偏低;
故答案为:偏低;
(4)洗气瓶C中的溶液用试剂代替,需要一定量的试剂反应后,有明显反应现象判断反应完成,
A.NaOH溶液能吸收二氧化硫但无明显现象,不能判断反应完成,故A错误;
B.品红试剂 能吸收二氧化硫,当品红红色说明反应恰好反应完全,能代替,故B正确;
C.酸性高锰酸钾溶液和二氧化硫反应到紫红色褪去证明反应进行完全,可以代替,故C正确;
D.Na2CO3溶液可以吸收二氧化硫但无明显的反应现象判断反应完成,故D错误;
故答案为:BC.
点评 本题考查学生对实验原理与实验操作的理解、实验方案设计、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

| A. | 除去溴苯中的溴:加入CCl4后分液 | |
| B. | 除去乙醇中的乙酸:加入NaOH溶液后分液 | |
| C. | 除去乙烷中的乙烯:加入氢气后在一定条件下充分反应 | |
| D. | 除去苯甲醛中的苯甲酸:加入生石灰后蒸馏 |
| A. | 物质可分为纯净物和混合物 | |
| B. | 碳酸钠既是钠盐也是碳酸盐 | |
| C. | 氧化物分为金属氧化物和非金属氧化物 | |
| D. | 化合物分为电解质和非电解质 |
| A. | N2O 与 CO2均不含非极性键 | |
| B. | N2O 的电子式可 | |
| C. | N2O 为三角形分子 | |
| D. | N2O 与 SiO2互为等电子体,具有相似的结构和相似性质 |
 如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )
如图是M、N两种不含结晶水的固体物质溶解度曲线.下列说法中正确的是( )| A. | t1℃时,N比M的溶解度大 | |
| B. | 温度从t1℃升高到t3℃时,N的饱和溶液张溶质的质量分数将增大 | |
| C. | M比N的溶解度大 | |
| D. | N中含有少量M时,可用降温结晶法提纯N |
| A. | 简单氢化物的稳定性:R>B>C | |
| B. | R分别与A、B、C均组成共价化合物 | |
| C. | 单质的沸点:R>B>A>C | |
| D. | 最高价氧化物对应的水化物的酸性:C>B |
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥甲烷、乙烯和苯在工业上都可通过石油分馏得到,乙烯能使高锰酸钾酸性溶液褪色
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
⑧结合质子能力:OH->CH3COO->Cl-
⑨酸性:H3PO4>H2SO4>HClO4
⑩在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用HCl.
| A. | 仅有②④⑥ | B. | 仅有①⑤⑦⑨⑩ | C. | 仅有②③④ | D. | 仅有①⑤⑥⑦⑨⑩ |

 、2Fe+3Br2=2FeBr3;写出B的试管中还发生的反应化学方程式HBr+AgNO3=AgBr↓+HNO3
、2Fe+3Br2=2FeBr3;写出B的试管中还发生的反应化学方程式HBr+AgNO3=AgBr↓+HNO3