题目内容
20.短周期主族元素R、A、B、C的原子序数依次增大.R、A原子的最外层电子数之和等于B、C原子的最外层电子数之和,C原子的最内层电子数和次外层电子数之和等于最外层电子数的两倍,B在周期表中主族序数等于最内层电子数的2倍.常温常压下BR4呈气态.下列说法中正确的是( )| A. | 简单氢化物的稳定性:R>B>C | |
| B. | R分别与A、B、C均组成共价化合物 | |
| C. | 单质的沸点:R>B>A>C | |
| D. | 最高价氧化物对应的水化物的酸性:C>B |
分析 短周期主族元素R、A、B、C的原子序数依次增大.C原子的最内层电子数和次外层电子数之和等于最外层电子数的两倍,原子有3个电子层,最外层电子数为5,故C为P元素;B在周期表中主族序数等于最内层电子数的2倍,则B处于IVA族,常温常压下BR4呈气态,R表现-1价,R为H元素或ⅦA族元素,若R为H元素,R、A原子的最外层电子数之和等于B、C原子的最外层电子数之和,即A元素原子最外层电子数为5+4-1=8,不符合题意,可推知B为Si,R为F元素,则A元素原子最外层电子数为5+4-7=2,原子序数介于氟、Si之间,故A为Mg.
解答 解:短周期主族元素R、A、B、C的原子序数依次增大.C原子的最内层电子数和次外层电子数之和等于最外层电子数的两倍,原子有3个电子层,最外层电子数为5,故C为P元素;B在周期表中主族序数等于最内层电子数的2倍,则B处于IVA族,常温常压下BR4呈气态,R表现-1价,R为H元素或ⅦA族元素,若R为H元素,R、A原子的最外层电子数之和等于B、C原子的最外层电子数之和,即A元素原子最外层电子数为5+4-1=8,不符合题意,可推知B为Si,R为F元素,则A元素原子最外层电子数为5+4-7=2,原子序数介于氟、Si之间,故A为Mg.
A.非金属性R(氟)>C(P)>B(Si),故氢化物稳定性R(氟)>C(P)>B(Si),故A错误;
B.氟分别与磷、硅组成共价化合物,但氟与Mg组成离子化合物,故B错误;
C.常温下氟气为气体,其它三种单质均为固体,氟气的沸点最低,故C错误;
D.非金属性C(P)>B(Si),非金属性越强,最高价含氧酸的酸性越强,故最高价氧化物对应的水化物的酸性:C>B,故D正确.
故选:D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,属于易错题目,学生容易根据BR4呈气态判断R为H元素,而忽略四氟化硅,导致无法推断元素,难度较大.

 口算能手系列答案
口算能手系列答案| A. | HCl溶液 | B. | NaOH溶液 | C. | Na2SO4溶液 | D. | 氨水 |
| 实 验 事 实 | 结 论 | |
| A | A、B两种有机物具有相同的相对分子质量和不同的结构 | A、B互为同分异构体 |
| B | 质量相同的A、B两种有机物完全燃烧生成质量相同的水 | A、B两有机物最简式相同 |
| C | A、B两种有机物结构相似具有相同的通式 | A、B互为同系物 |
| D | 分子式为C6H6的烃A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 | A的结构简式可能是 CH2═CH-C≡C-CH═CH2 |
| A. | A | B. | B | C. | C | D. | D |

(1)已知常温下氯酸钾与浓盐酸反应放出氯气,装置1不能(填“能”或“不能”)证明非金属性Cl>Br>I.若不能,请在装置1的实验基础上,再选择三种试剂来完成一个简单的实验,以弥补上述装置的不足,此三种试剂为溴水、碘化钾溶液、四氯化碳溶液(若能证明,此问可不作答)
(2)装置2中仪器①的名称为分液漏斗,若想用装置2来探究非金属性Cl>C>Si,则仪器①中所盛装的试剂为HClO4溶液.
| 金属 | 电压表指针偏转方向 | 电压/V |
| Al | 指向Cu | +0.78 |
| 甲 | 指向甲 | -0.15 |
| 乙 | 指向Cu | +1.35 |
| Fe | 指向Cu | +0.30 |
| 丙 | 指向Cu | +0.45 |
A.在三种金属中乙的还原性最强
B.金属甲能从硫酸铜溶液中置换出铜
C.乙、丙若形成原电池时,乙为正极
D.甲、乙形成合金时,将该合金露置在空气中,乙先被腐蚀.
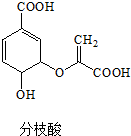
| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 分子中含有2种官能团 | |
| C. | 1mol分枝酸最多可与3molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
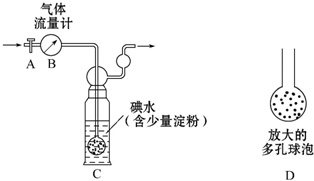 硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某化学研究性学习小组的同学欲采用以下方案测定硫酸工业尾气中SO2含量
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某化学研究性学习小组的同学欲采用以下方案测定硫酸工业尾气中SO2含量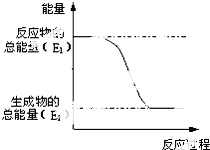 (1)“西气东输”中的“气”指天然气,其主要成分的化学式是CH4,
(1)“西气东输”中的“气”指天然气,其主要成分的化学式是CH4,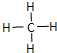 .一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.
.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填“>”或“<”),该反应放出 (填“放出”或“吸收”)能量.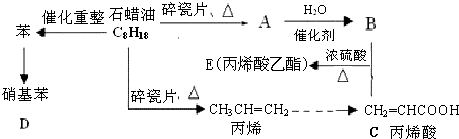
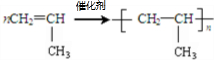 ;反应类型加聚反应.
;反应类型加聚反应.